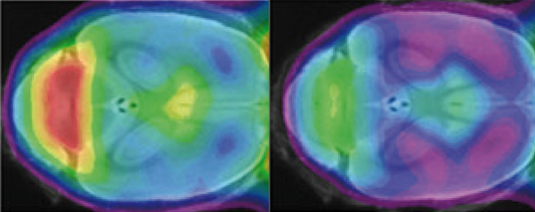
 Una modifica minima nella TREM2 genera una riduzione marcata dell'attività fagocitica delle cellule microgliali nel cervello dei topi mutanti (verde, a destra) rispetto al controllo (giallo e rosso a sinistra). Fonte: Haass Lab.L'impatto preciso delle microglia nelle malattie neurodegenerative come l'Alzheimer e il Parkinson è ancora poco chiaro.
Una modifica minima nella TREM2 genera una riduzione marcata dell'attività fagocitica delle cellule microgliali nel cervello dei topi mutanti (verde, a destra) rispetto al controllo (giallo e rosso a sinistra). Fonte: Haass Lab.L'impatto preciso delle microglia nelle malattie neurodegenerative come l'Alzheimer e il Parkinson è ancora poco chiaro.
Nel cervello, le cellule microgliali migrano verso i siti di danno neurale in risposta ai segnali neuro-infiammatori e eliminano le cellule morenti e i detriti cellulari insolubili inghiottendoli e digerendoli enzimaticamente.
Le microglia quindi hanno sostanzialmente lo stesso ruolo di quello che le cellule immunitarie chiamate 'macrofagi' hanno in altri tessuti. Tuttavia, le risposte neuro-infiammatorie possono anche contribuire alla patogenesi della neurodegenerazione, in quanto le microglia sono conosciute per essere attive in quasi tutti i tipi di demenza.
Ciò può semplicemente riferirsi al loro ruolo di cellule fagocitiche nel degrado dei depositi di proteine extracellulari (placche di amiloide) che sono un segno distintivo dell'Alzheimer. Ma è anche possibile che le microglia attivate promuovano la progressione della malattia secernendo i segnali molecolari che esacerbano le risposte infiammatorie che sono in ultima analisi deleterie per le cellule nervose sane.
Il nuovo studio è stato eseguito da un team interdisciplinare tedesco-svizzero di biologi cellulari, radiologi e neuropatologi guidati dal professor Christian Haass, cattedra di Biochimica Metabolica alla LMU e presidente del Centro Tedesco Malattie Neurodegenerative (DZNE) di Monaco.
Per chiarire se le microglia sono buone o cattive, i ricercatori si sono concentrati sulla funzione del gene TREM2 che, nel cervello, è espresso prevalentemente nelle microglia. Inoltre, le mutazioni che compromettono la sua espressione, o la funzione del suo prodotto proteico, sono associate ad un aumento del rischio di condizioni neurodegenerative come Alzheimer, Parkinson e demenza frontotemporale (FTD).
Con l'aiuto del sistema di editing genetico CRISPR / Cas9, Haass e i suoi colleghi hanno modificato una singola subunità (base-pair) nella sequenza codificante del gene TREM2 dei topi, che dirige la sintesi della proteina TREM2. Nell'uomo, questa stessa mutazione è associata ad un aumento del rischio di una forma di FTD.
Negli studi precedenti, si è dimostrato che la proteina TREM2 normale è portata nella membrana cellulare per eseguire la sua funzione biologica. La mutazione introdotta dal sistema CRISPR interrompe questo processo, in modo tale che si esprima solo una minima parte della proteina sulla superficie delle cellule microgliali.
Nei topi, questa alterazione genetica porta ad una drastica alterazione della funzione microgliale, come dimostrano vari test. Ad esempio, il ceppo mutante non attiva più le sue cellule microgliali in risposta alla perdita neuronale nel cervello. Di conseguenza, le cellule non riescono a migrare ai siti di danni delle cellule, e le cellule morte, i detriti insolubili e le placche non possono essere smaltiti.
Inoltre, la mutazione ha conseguenze catastrofiche per il metabolismo energetico. Il cervello normale è totalmente dipendente dal glucosio come fonte di energia, ma la perdita della funzione della TREM2 porta ad una diminuzione significativa del consumo di glucosio nel cervello mutante. Inoltre il flusso di sangue al cervello nell'insieme è notevolmente ridotto.
Fenomeni simili sono osservati nei pazienti che portano mutazioni con perdite di funzione nel gene TREM2. Considerate nel complesso, queste osservazioni affermano che l'attivazione microgliale è indispensabile per la funzione cerebrale normale.
Christian Haass sintetizza le implicazioni più ampie dello studio come segue:
"I nostri risultati sottolineano il valore delle microglia per l'omeostasi nel cervello e implicano che queste cellule hanno una funzione immunoprotettiva, almeno nelle prime fasi della patogenesi delle malattie neurodegenerative. Riteniamo che i nostri dati forniscano la logica per un nuovo approccio allo sviluppo di terapie efficaci, basate sul potenziamento della risposta difensiva delle microglia. Se riusciremo a migliorare questa funzione, sia via farmaci che con altri mezzi, potremmo riuscire a ritardare l'insorgenza delle demenze".
Fonte: Ludwig-Maximilians Universität München (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Gernot Kleinberger, Matthias Brendel, Eva Mracsko, Benedikt Wefers, Linda Groeneweg, Xianyuan Xiang, Carola Focke, Maximilian Deußing, Marc Suárez‐Calvet, Fargol Mazaheri, Samira Parhizkar, Nadine Pettkus, Wolfgang Wurst, Regina Feederle, Peter Bartenstein, Thomas Mueggler, Thomas Arzberger, Irene Knuesel, Axel Rominger, Christian Haass. The FTD‐like syndrome causing TREM2 T66M mutation impairs microglia function, brain perfusion, and glucose metabolism. The EMBO Journal (2017), published online 30.05.2017. DOI 10.15252/embj.201796516
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.













 Associazione Alzheimer OdV
Associazione Alzheimer OdV