 Riassunto grafico dello studio Koutsodendris et al.
Riassunto grafico dello studio Koutsodendris et al.
Se sai di essere dentro il quasi 25% di persone con la variante genica nota come ApoE4, hai una possibilità superiore alla media di sviluppare il morbo di Alzheimer (MA). Ma mentre gli scienziati sanno da tempo che l'ApoE4 porta a cambiamenti nel cervello che possono contribuire alla demenza, l'esatto meccanismo di tale effetto non era ancora chiaro.
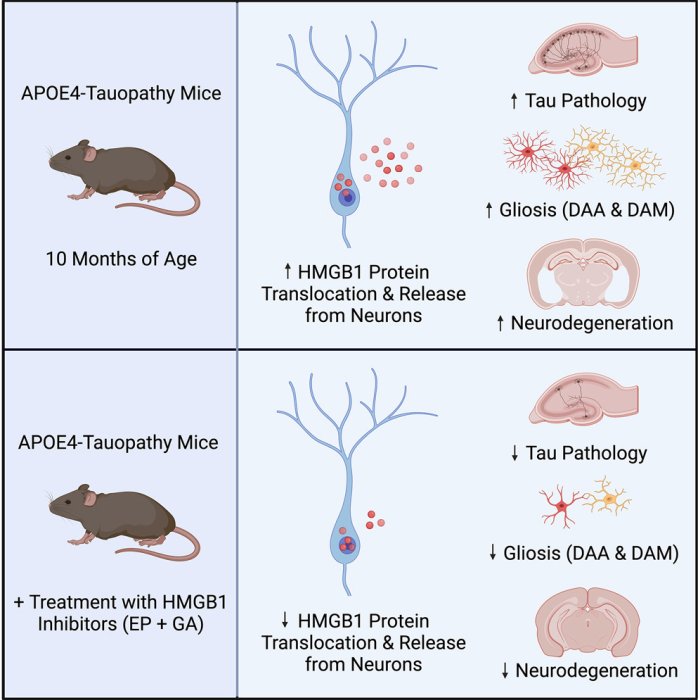
Ora, scienziati dei Gladstone Institutes hanno scoperto che i neuroni che producono ApoE4 rilasciano una molecola di segnalazione immunitaria chiamata HMGB1 in quantità molto più alta rispetto ai neuroni che producono altre varianti di ApoE. Al momento del rilascio, l'HMGB1 attiva le cellule immunitarie cerebrali chiamate microglia, che innescano l'infiammazione e la degenerazione dei neuroni.
Come descritto nel loro studio appena pubblicato su Cell Reports, quando i ricercatori hanno bloccato il rilascio di HMGB1 con una miscela di due farmaci sperimentali, i modelli di topo che producono ApoE4, e altri fattori che causano la demenza, hanno mostrato molte meno microglia attivate e meno neurodegenerazione nel cervello.
"Siamo rimasti piuttosto sorpresi ed entusiasti del fatto che puntare questo percorso porti a una protezione così forte contro la neurodegenerazione guidata dall'ApoE4", afferma l'autore senior Yadong Huang MD/PhD dei Gladstone, e professore di neurologia e patologia all'Università della California di San Francisco. "Ciò aiuta a rispondere a vecchie domande sul ruolo della neuroinfiammazione indotta da ApoE4 nel MA e indica anche nuovi modi per curare la malattia".
Cosa viene prima: neurodegenerazione o infiammazione?
Nel cervello, il MA ha diversi effetti su diversi tipi di cellule. Tra i cambiamenti associati alla malattia c'è l'accumulo di proteine tau e amiloide, l'attivazione delle microglia che promuove infiammazione e degenerazione e la morte finale dei neuroni. Ma gli scienziati non sono sicuri di quale di questi innesca gli altri.
"Potrebbe essere che i neuroni degenerano prima e ciò innesca l'attivazione delle microglia", afferma Huang. "Ma potrebbe anche essere che le microglia si attivano prima e quindi innescano la neurodegenerazione".
Per rispondere a questo dilemma uovo-o-gallina, il team di Huang ha esaminato l'attivazione delle microglia nel contesto dell'ApoE4, che stanno studiando da tempo come contributo principale al rischio genetico del MA.
L'ApoE4 è una delle tre versioni del gene ApoE. Le persone con una copia del gene ApoE4 (quasi un quarto di molte popolazioni) hanno 3,5 volte più probabilità di sviluppare il MA rispetto a quelle con la versione più comune, l'ApoE3. Quelle con due copie di ApoE4 (circa il 3% della popolazione) hanno un rischio superiore di 12 volte.
Huang e i suoi colleghi, tra cui Nicole Koutsodendris PhD, dottoranda del laboratorio di Huang e prima autrice del nuovo studio, si sono chiesti se i neuroni con la variante ApoE4 producono una qualsiasi molecola di segnalazione in grado di attivare le microglia. Sono arrivati presto alla molecola immunitaria HMGB1, che è nota per innescare forti risposte infiammatorie in alcuni tumori e infezioni.
Nei primi esperimenti, gli scienziati hanno cercato di vedere dove si trovava la molecola HMGB1 nei neuroni del cervello di topi modello di MA portatori delle varianti ApoE3 o ApoE4.
"Abbiamo visto schemi davvero sorprendenti", afferma la Koutsodendris. "Quando i neuroni con ApoE4 sono stati esposti a stress, l'HMGB1 si è spostato dal nucleo al citoplasma delle cellule ed è stato quindi rilasciato nello spazio al di fuori della cellula, mentre nei neuroni con ApoE3, l'HMGB1 è rimasto all'interno del nucleo".
Ulteriori studi sui topi modello hanno mostrato che la rimozione selettiva di ApoE4 dai neuroni ha impedito all'HMGB1 di essere rilasciato dai neuroni, confermando il legame tra ApoE4 neuronale e il rilascio di HMGB1.
Nuovo obiettivo di farmaci
Infine, gli scienziati hanno studiato l'impatto di due farmaci sperimentali che bloccano il rilascio di HMGB1. Hanno dimostrato che una miscela di entrambi i farmaci ha ridotto l'attivazione delle microglia e lo sviluppo di neurodegenerazione nei topi modello di demenza che producevano ApoE4.
"È stato un risultato molto chiaro: il blocco dell'uscita di HMGB1 dai neuroni protegge questi topi da molti aspetti diversi della patologia del MA", afferma Huang.
L'ApoE4 ha anche altri impatti sui neuroni, ma, in base ai loro risultati, i ricercatori ipotizzano che senza l'attivazione delle microglia, questi altri effetti non sono sufficienti per generare la neurodegenerazione. Pertanto, Huang e il suo team ritengono che i farmaci che puntano l'HMGB1 potrebbero infine essere una possibilità per prevenire o trattare il MA legato all'ApoE4.
"Queste piccole molecole sono già state usate in studi clinici per altre malattie e quindi potrebbero potenzialmente esse testati subito negli studi per il MA", afferma Huang. "Ma stiamo anche continuando la nostra ricerca ed esplorando altri modi, compresi nuovi farmaci, che potrebbero puntare l'HMGB1, il suo rilascio dai neuroni e il suo impatto sulle microglia".
Fonte: Sarah C.P. Williams in Gladstone Institutes (> English) - Traduzione di Franco Pellizzari.
Riferimenti: N Koutsodendris, [+14], Y Huang. ApoE4-promoted gliosis and degeneration in tauopathy are ameliorated by pharmacological inhibition of HMGB1 release. Cell Reports, 19 Oct 2023, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.








 Associazione Alzheimer OdV
Associazione Alzheimer OdV