Ricercatori dell'Universitat Autònoma de Barcelona, del Karolinska Institute (KI) e della società biotecnologica BioArctic, entrambi in Svezia, hanno combinato la microscopia STED, una tecnologia che consente di visualizzare a super risoluzione, e un nuovo anticorpo creato da poco, per osservare gli aggregati amiloidogenici caratteristici dell'Alzheimer. Il lavoro, che supera le possibilità della microscopia confocale convenzionale, consentirà ulteriori studi sulla struttura e sulla morfologia dei depositi di amiloidi e sui meccanismi coinvolti nella loro formazione.
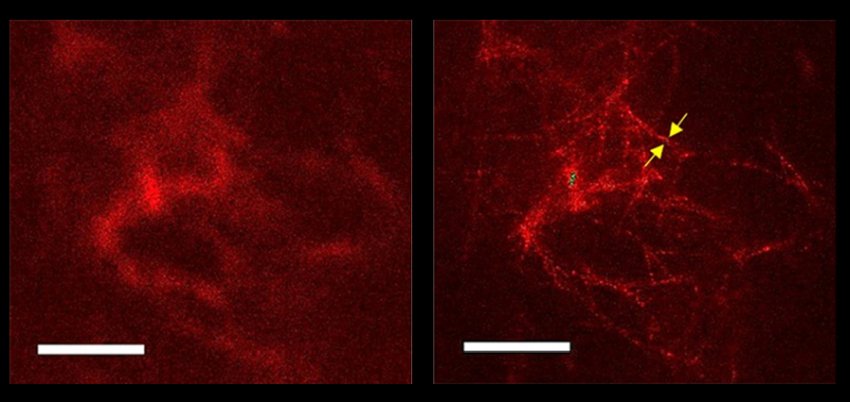 Immagini di placche amiloidi aggregate nel tessuto cerebrale di un topo modello di Alzheimer incubato con l'anticorpo usato nello studio. A sinistra, immagine da microscopio confocale, a destra, quella della microscopia STED.
Immagini di placche amiloidi aggregate nel tessuto cerebrale di un topo modello di Alzheimer incubato con l'anticorpo usato nello studio. A sinistra, immagine da microscopio confocale, a destra, quella della microscopia STED.
Nel cervello dei pazienti con morbo di Alzheimer (MA) ci sono accumuli di placche composte di aggregati di proteine amiloide-beta (Aβ), che sono collegati al deterioramento dei tessuti e al malfunzionamento cerebrale.
Il componente principale di queste placche è costituito da catene di circa 40-42 aminoacidi, che con la microscopia confocale convenzionale possono essere descritti solo nell'insieme come placche amorfe, dense o diffuse.
Questa visione classica è lontana dalle fibre singole osservate con la microscopia elettronica, dove appaiono simili a fili, tra 6 e 10 nanometri di diametro, non ramificati e spesso formati da filamenti avvolti l'uno attorno all'altro. Tuttavia, sebbene la microscopia elettronica offra una risoluzione maggiore, ha anche diversi inconvenienti, come un costo molto elevato e un processo di preparazione del campione che aumenta il rischio di artefatti.
In questo studio, per esaminare la struttura e la morfologia degli aggregati Aβ, il team di ricerca ha valutato l'uso di un terzo tipo di microscopia, la STED (stimulated emission depletion, deplezione di emissione stimolata). Con questa tecnologia, sviluppata dal premio Nobel SW Hell, gli scienziati hanno esaminato sezioni cerebrali dei topi modello di MA, insieme a un nuovo anticorpo umano ricombinante marcato a fluorescenza che reagisce selettivamente agli aggregati Aβ.
Lo studio, pubblicato su Cell & Bioscience, descrive i dettagli della struttura della placca che non erano stati risolti con la microscopia ottica convenzionale.
"Abbiamo raggiunto una risoluzione spaziale che supera di 5-10 volte le capacità della microscopia confocale convenzionale, sia in campioni in vitro che nelle sezioni del tessuto cerebrale, e siamo riusciti a distinguere le singole fibre all'interno delle placche, una pietra miliare che era possibile finora solo con la microscopia elettronica", spiega il dott. Björn Johansson, primo autore dello studio, ricercatore nel Dipartimento di Neuroscienze Cliniche del KI.
"Questo è un importante progresso sul campo, che ci consentirà di caratterizzare ulteriormente i meccanismi coinvolti nella deposizione di Aβ nelle placche e la sua successiva rimozione", aggiunge Vladana Vukojevic, coautrice e ricercatrice nello stesso dipartimento.
Per Lydia Giménez-Llort, coautrice dello studio e ricercatrice del Dipartimento di Psichiatria e Medicina legale e dell'Istituto di Neuroscienze dell'UAB,
"La capacità di ottenere queste immagini in animali che erano tenuti sotto osservazione comportamentale ci consentirà di capire meglio lo sviluppo e la progressione dei sintomi cognitivi e neuropsichiatrici, con l'obiettivo di trovare correlazioni biochimiche e neuropatologiche significative".
Gli autori concordano sul fatto che gli studi precedenti sul MA condotti con la microscopia ottica convenzionale mancano di informazioni, che ora possono essere trovate con questa nuova metodologia, sul ruolo degli aggregati Aβ nella patogenesi della malattia, e concludono:
"La microscopia STED sta emergendo come uno strumento indispensabile per guidare i progressi scientifici nella ricerca sul MA".
Fonte: Universitat Autònoma de Barcelona (> English) - Traduzione di Franco Pellizzari.
Riferimenti: B Johansson, [+9], V Vukojević. The interwoven fibril-like structure of amyloid-beta plaques in mouse brain tissue visualized using super-resolution STED microscopy. Cell & Bioscience, 2023, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.









 Associazione Alzheimer OdV
Associazione Alzheimer OdV