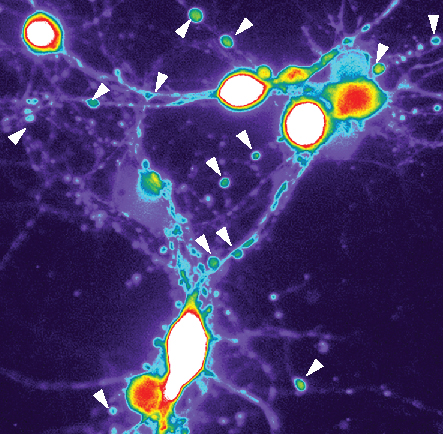
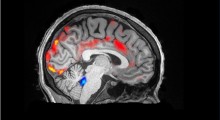
 I neuroni trattati con le proteine dell'Alzheimer mostrano un aumento drastico di calcio (blu, verde, giallo, rosso fino al bianco) e le cellule formano strutture a perla con tau (evidenziate dalle frecce) identiche ai neuroni dei pazienti di Alzheimer.Nel cervello delle persone con Alzheimer ci sono depositi anomali di proteine amiloide-beta e tau e sciami di cellule immunitarie attivate. Ma gli scienziati non capiscono ancora come si combinano questi tre fattori principali per guidare la malattia.
I neuroni trattati con le proteine dell'Alzheimer mostrano un aumento drastico di calcio (blu, verde, giallo, rosso fino al bianco) e le cellule formano strutture a perla con tau (evidenziate dalle frecce) identiche ai neuroni dei pazienti di Alzheimer.Nel cervello delle persone con Alzheimer ci sono depositi anomali di proteine amiloide-beta e tau e sciami di cellule immunitarie attivate. Ma gli scienziati non capiscono ancora come si combinano questi tre fattori principali per guidare la malattia.
Ora, ricercatori della University of North Carolina e dei National Institutes of Health hanno messo a nudo il mistero negli esperimenti di laboratorio, rivelando perché è promettente un farmaco di Alzheimer attualmente in sviluppo e come altre terapie potrebbero invertire il processo della malattia.
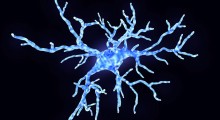
Guidati da Todd Cohen PhD, assistente di neurologia, gli scienziati dell'UNC hanno usato cellule umane in coltura per dimostrare che l'amiloide-beta scatena una drammatica risposta infiammatoria nelle cellule immunitarie e che tale interazione danneggia i neuroni. Poi hanno mostrato come tale tipo di danni al neurone porta alla formazione di strutture a forma di perla, piene di proteine tau anomali. Sappiamo già che strutture di tipo perla si formano nelle cellule cerebrali delle persone con Alzheimer.
I ricercatori dell'UNC hanno anche identificato due proteine - MMP-9 e HDAC6 - che contribuiscono a promuovere questa cascata dannosa amiloide-infiammazione-tau. Queste proteine, e altre associate a loro, potrebbero diventare bersagli farmacologici per trattare o prevenire l'Alzheimer.
"È interessante essere riusciti a osservare la tau - la proteina principale dell'Alzheimer - all'interno di queste strutture a perla", ha dichiarato Cohen, che fa parte anche del Centro Neuroscienze dell'UNC. "Pensiamo che, impedendo che si formino queste strutture, si potrebbero lasciare alle persone neuroni più sani e più resistenti all'Alzheimer".
I risultati, pubblicati ieri nella rivista Cell Reports, sono stati resi possibili grazie a una collaborazione di tre laboratori dell'UNC guidati da Rick Meeker PhD, Xian Chen PhD e Cohen, nonché dal laboratorio di Jau-Shyong Hong PhD dei NIH. Per iniziare lo studio, Cohen, Meeker e colleghi hanno esposto cellule immunitarie, presenti di solito in uno stato attivato e infiammatorio nel cervello di Alzheimer, a minuscoli gruppi di amiloide-beta (oligomeri), che sono considerati le forme più dannose della proteina.
"Pensavamo che gli oligomeri di amiloide-beta avrebbero attivato una risposta infiammatoria in queste cellule immunitarie, come suggeriva una precedente ricerca di Meeker e volevamo capire se ciò avrebbe indotto forme patologiche di tau quando somministrati ai neuroni", ha detto Cohen.
I ricercatori si sono quindi concentrati sul fluido in cui le cellule immunitarie stavano crescendo. Questo fluido, pieno di fattori infiammatori - o proteine - somigliava al fluido in cui queste cellule vivono abitualmente all'interno del cervello umano. Il team di Cohen ha aggiunto questo fluido alle colture dei neuroni corticali umani. I neuroni hanno sviluppato presto gonfiori anomali, a forma di perla, lungo i loro assoni e dendriti che erano stati ben studiati in precedenza nel laboratorio di Meeker.
Questo 'perlatura neuritica' sugli assoni e sui dendriti è stata osservata nei pazienti di Alzheimer ed è considerata un segno precoce del danno neuronale, anche se non era chiaro come la perlatura possa essere collegata alla tau anomala o se la perlatura porti all'Alzheimer.
Il team di Cohen ha cercato poi la tau nelle perle e ne ha trovato uno straordinario accumulo, anche se era in forma anomala e non rilevabile con i soliti strumenti che gli scienziati usano per individuare il tipo di tau tipico dei pazienti di Alzheimer. Invece, la tau nelle perle era modificata in modo diverso da come si pensava prima. Questo cambiamento è ciò che secondo Cohen induce la tau ad aggregarsi.
Le proteine Tau di norma danno supporto strutturale alle strutture longitudinali chiamate microtubuli, che vengono usate per trasportare molecole cruciali lungo gli assoni. Per ragioni che non sono mai state chiarite, le proteine tau nei neuroni affetti da Alzheimer hanno un modello diverso: sono staccate dai microtubuli, portano modifiche chimiche anomale e si aggregano in grumi lunghi, aggrovigliati e filiformi. Non è chiaro se questi agglomerati tau danneggiano attivamente i neuroni, ma studi precedenti avevano suggerito che la perdita di tau dai microtubuli e la conseguente disfunzione del trasporto assonale potrebbero causare gravi danni.
La scoperta di tau anomala nelle perle neuritiche indica che queste perle potrebbero segnare l'ingresso della tau nel processo dell'Alzheimer. All'interno delle perle, il laboratorio di Cohen ha trovato anche livelli elevati di calcio, che sappiamo essere dannosi per i neuroni e sono considerati una caratteristica importante dei neuroni nelle persone con Alzheimer.
"Pensiamo che questi fattori neuroinfiammatori innescano questa cascata", ha detto Cohen. "Inondano il neurone con calcio. E pensiamo che una volta che il calcio si accumula, provoca la trasformazione anomala della tau. Questo probabilmente porta ad un effetto valanga: la tau si stacca dai microtubuli e viene trasportata per tutto il neurone, finendo in queste perle. Una possibilità è che queste perle piene di tau siano i luoghi dove infine emergono i classici agglomerati di tau, che sono il segno distintivo dell'Alzheimer".
Un team guidato dal ricercatore associato Xian Chen, professore associato di biochimica e biofisica all'UNC, ha usato la spettrometria di massa per individuare le molecole neuroinfiammatorie indotte dall'amiloide-beta che avevano innescato l'afflusso di calcio e la formazione di neuriti. Sono riusciti a dimostrare che una proteina in particolare, la MMP-9, è responsabile di alcuni di questi effetti avversi.
"La MMP-9 è una proteina infiammatoria che è elevata nel cervello dei pazienti di Alzheimer", ha dichiarato Cohen. "Nel nostro studio dimostriamo che la MMP-9 da sola può innescare un flusso di calcio che inonda il neurone".
I ricercatori hanno anche identificato la proteina HDAC6, che origina dall'interno dei neuroni e si concentra nelle perle neuritiche. Si ritiene che, di norma, l'HDAC6 rilevi gli aggregati proteici indesiderati all'interno dei neuroni e li porti via per essere smaltiti. Tuttavia, negli esperimenti del laboratorio di Cohen il blocco dell'HDAC6 ha impedito la formazione di quasi tutte le perle.
Entrambe queste proteine sono elevate nelle aree colpite del cervello di Alzheimer. Le aziende farmaceutiche stanno ora sviluppando e testando inibitori dell'HDAC6, che hanno avuto risultati sorprendentemente buoni negli studi preliminari, anche se non sappiamo bene come funzionano questi inibitori.
"Il nostro lavoro potrebbe spiegare perché gli inibitori dell'HDAC6 si sono dimostrati così promettenti inizialmente", ha detto Cohen. "E pensiamo che il nostro lavoro possa aiutare a informare lo sviluppo di altri tipi di inibitori che influenzano questa cascata, in particolare quelli che possono impattare sui processi cognitivi".
Una strategia terapeutica per bloccare HDAC6 e/o MMP-9 potrebbe avere applicazioni oltre all'Alzheimer. La formazione di neuriti è nota in molte altre malattie neurodegenerative e dopo lesioni alla testa. Gli scienziati hanno persino osservato la perlatura a piccole dosi in cervelli anziani apparentemente sani. La perlatura potrebbe essere un meccanismo generale che sottende il declino cognitivo, ha detto Cohen.
Nel loro studio, Cohen e colleghi hanno trovato alcune perle neuriti piene di tau nel cervello di topi invecchiati. E hanno scoperto che la neuroinfiammazione cronica potrebbe indurre le perle a formarsi nei topi più giovani. Essi sono ora concentrati sulla creazione di un modello di topo per confermare e approfondire il processo amiloide-infiammazione-tau visto in questo studio.
"Se riuscissimo a dimostrare questa cascata in un topo non manipolato, allora potremo studiare l'Alzheimer e testare le terapie in un normale laboratorio senza la necessità di un'ingegneria genetica artificiale usata nei modelli tradizionali di topi di Alzheimer", ha dichiarato Cohen.
Fonte: Mark Derewicz in University of North Carolina at Chapel Hill (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Jui-Heng Tseng, Ling Xie, Sheng Song, Youmei Xie, Lauren Allen, Deepa Ajit, Jau-Shyong Hong, Xian Chen, Rick B. Meeker, Todd J. Cohen. The Deacetylase HDAC6 Mediates Endogenous Neuritic Tau Pathology. Cell Reports, Volume 20, Issue 9, p2169–2183, 29 August 2017, DOI: 10.1016/j.celrep.2017.07.082
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali colelgamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.







 Associazione Alzheimer OdV
Associazione Alzheimer OdV