Un probabile innesco dell'Alzheimer è l'accumulo di molecole chiamate peptidi amiloidi, che causano la morte cellulare e sono comuni nel cervello di chi ha la malattia. Ricercatori della Chalmers University of Technology, hanno ora dimostrato che le cellule di lievito che accumulano questi peptidi amiloidi mal ripiegati possono recuperare dopo essere state trattate con nanofiocchi di ossido di grafene.
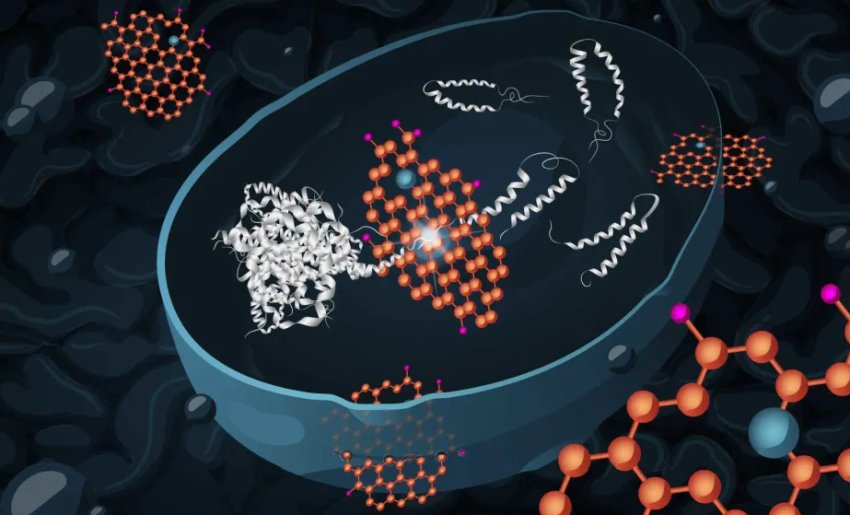 L'ossido di grafene (arancio) può entrare efficacemente nelle cellule di lievito e ridurre la tossicità degli aggregati proteici dannosi (grigio chiaro), smontando e quindi degradando gli aggregati.
L'ossido di grafene (arancio) può entrare efficacemente nelle cellule di lievito e ridurre la tossicità degli aggregati proteici dannosi (grigio chiaro), smontando e quindi degradando gli aggregati.
Il morbo di Alzheimer (MA) è una malattia cerebrale incurabile, che porta alla demenza e alla morte, con sofferenza sia per i pazienti che per le loro famiglie. Si stima che oltre 40 milioni di persone in tutto il mondo vivano con la malattia o una forma correlata di demenza. Secondo statistiche, il costo globale stimato di queste malattie è l'1% del prodotto interno lordo globale.
Si ritiene che i peptidi di amiloide-beta mal ripiegati (peptidi Aβ), che si accumulano e si aggregano nel cervello, siano la causa sottostante il MA. Essi attivano una serie di processi dannosi nei neuroni (cellule cerebrali), causando la perdita di molte funzioni cellulari vitali o la morte stessa delle cellule, e quindi una perdita di funzione cerebrale nell'area interessata.
Ad oggi, non esistono strategie efficaci per il trattamento dell'accumulo di amiloide nel cervello, però ricercatori della Chalmers University of Technology di Göteborg (Svezia) hanno ora dimostrato che il trattamento con ossido di grafene riduce i livelli di peptidi Aβ aggregati in un modello di cellule di lievito.
"Questo effetto dell'ossido di grafene è stato recentemente dimostrato anche da altri ricercatori, ma non nelle cellule di lievito", afferma Xin Chen, ricercatrice di biologia dei sistemi alla Chalmers e prima autrice dello studio. “Il nostro studio spiega anche il meccanismo alla base dell'effetto. L'ossido di grafene influenza il metabolismo delle cellule, in un modo che aumenta la loro resistenza alle proteine mal ripiegate e allo stress ossidativo. Questo non era ancora stato provato".
Studiare i meccanismi sul lievito di birra
Nel MA, gli aggregati amiloidi esercitano i loro effetti neurotossici causando vari disturbi metabolici cellulari, come lo stress nel reticolo endoplasmatico, una parte importante della cellula in cui vengono prodotte molte delle sue proteine. Ciò può ridurre la capacità delle cellule di gestire le proteine mal ripiegate e di conseguenza aumentare l'accumulo di queste proteine.
Gli aggregati influenzano anche la funzione dei mitocondri, le centrali energetiche delle cellule. Pertanto, i neuroni sono esposti ad un aumento di stress ossidativo (molecole reattive chiamate radicali di ossigeno, che danneggiano altre molecole); una cosa a cui le cellule cerebrali sono particolarmente sensibili.
I ricercatori della Chalmers hanno condotto lo studio mediante una combinazione di analisi delle proteine (proteomica) ed esperimenti di conferma. Hanno usato il lievito di birra, il Saccharomyces cerevisiae, come modello in vivo delle cellule umane. I due tipi di cellule hanno sistemi molto simili per il controllo della qualità delle proteine. Questo modello di cellule di lievito era stato definito in precedenza dal gruppo di ricerca per imitare i neuroni umani colpiti dal MA.
"Le cellule di lievito nel nostro modello assomigliano ai neuroni colpiti dall'accumulo di amiloide-beta42, che è la forma del peptide amiloide più soggetta alla formazione di aggregati", afferma Xin Chen. "Queste cellule invecchiano più velocemente del normale, mostrano stress nel reticolo endoplasmatico e disfunzione mitocondriale, e hanno un'elevata produzione di radicali reattivi di ossigeno dannosi".
Alte speranze dai nanofiocchi di ossido di grafene
I nanofiocchi di ossido di grafene sono nanomateriali bidimensionali di carbonio con proprietà uniche, come conducibilità eccezionale ed elevata biocompatibilità. Sono ampiamente usati in vari progetti di ricerca, tra cui sviluppo di trattamenti per il cancro, sistemi di rilascio di farmaci e biosensori.
I nanofiocchi sono idrofili (solubili in acqua) e interagiscono bene con biomolecole come le proteine. Quando l'ossido di grafene entra nelle cellule viventi, è in grado di interferire con i processi di autoassemblaggio delle proteine.
"Di conseguenza, può ostacolare la formazione di aggregati proteici e promuovere la disintegrazione degli aggregati esistenti", afferma Santosh Pandit, ricercatore di biologia dei sistemi alla Chalmers e coautore dello studio. "Riteniamo che i nanofiocchi agiscano attraverso due percorsi indipendenti per mitigare gli effetti tossici dell'amiloide-beta42 nelle cellule di lievito".
In uno dei percorsi, l'ossido di grafene agisce direttamente per prevenire l'accumulo di amiloide-beta42. Nell'altro, l'ossido di grafene agisce indirettamente con un meccanismo (attualmente sconosciuto), in cui vengono attivati geni specifici della risposta allo stress. Ciò aumenta la capacità della cellula di gestire proteine mal ripiegate e stress ossidativo.
Come trattare i pazienti di Alzheimer è ancora una domanda per il futuro. Tuttavia, secondo il gruppo di ricerca della Chalmers, l'ossido di grafene ha un grande potenziale per la ricerca futura nel campo delle malattie neurodegenerative. Il gruppo di ricerca è già riuscito a dimostrare che il trattamento con ossido di grafene riduce anche gli effetti tossici degli aggregati proteici specifici della malattia di Huntington in un modello di lievito.
"Il prossimo passo è indagare se è possibile sviluppare un sistema di rilascio di farmaci basato sull'ossido di grafene per il MA", dice Xin Chen. "Vogliamo anche verificare se l'ossido di grafene ha effetti benefici in ulteriori modelli di malattie neurodegenerative, come il Parkinson".
Fonte: Chalmers University of Technology (> English) - Traduzione di Franco Pellizzari.
Riferimenti: X Chen, [+8], I Mijakovic. Graphene Oxide Attenuates Toxicity of Amyloid-β Aggregates in Yeast by Promoting Disassembly and Boosting Cellular Stress Response. Advanced Functional Materials, 2023, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.









 Associazione Alzheimer OdV
Associazione Alzheimer OdV