Dei ricercatori hanno scoperto come vengono degradate le proteine mal ripiegate presenti all'esterno delle cellule, impedendo loro di causare problemi di salute.
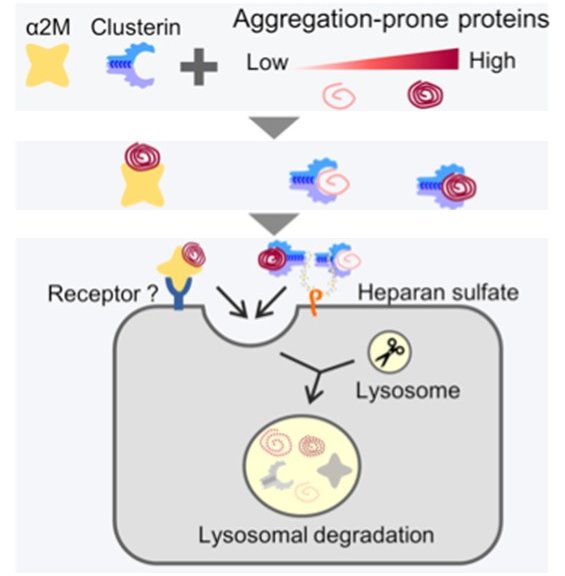 Schema della degradazione lisomatica per mezzo dei chaperoni α2M e clusterina. (Fonte: Tomihari et al.)
Schema della degradazione lisomatica per mezzo dei chaperoni α2M e clusterina. (Fonte: Tomihari et al.)
Se esposte a condizioni stressanti, diverse proteine tendono a piegarsi in modo errato e ad aggregarsi all'interno o all'esterno delle cellule. Questi aggregati, se accumulati, possono contribuire ai disturbi legati all'età, compreso il morbo di Alzheimer (MA).
I chaperoni (=ciceroni, accompagnatori) extracellulari stabilizzano le proteine mal ripiegate per impedire la loro aggregazione e sono implicati nell'eliminazione di queste proteine difettose esterne alle cellule, ma i loro meccanismi sono poco chiari. Ora, ricercatori dell'Università di Chiba (Giappone) hanno sviluppato un test in grado di rilevare quantitativamente questo processo e hanno scoperto che i chaperoni extracellulari mediano la degradazione lisosomiale delle proteine extracellulari mal ripiegate.
Le proteine tendono a piegarsi erroneamente e a diventare difettose se esposte a fattori di stress come calore, ossidazione e cambiamenti del pH. L'accumulo di proteine anormali contribuisce a malattie neurodegenerative come il MA. Allora, in che modo il corpo umano gestisce queste proteine mal ripiegate o difettose? Regolando le reti proteiche attraverso un processo chiamato 'proteostasi', che impedisce l'aggregazione proteica e qualsiasi danno che può derivare dall'accumulo di proteine mal ripiegate all'interno (intracellulari) o all'esterno (extracellulari) delle cellule.
Un insieme di proteine uniche, i chaperoni molecolari, hanno un ruolo essenziale nella proteostasi: puntano e interagiscono con le proteine mal ripiegate, mantengono la loro solubilità e le designano per un nuovo piegamento o per la degradazione. E, mentre la proteostasi intracellulare è ben compresa, le condizioni extracellulari sono più ostiche.
Mediare la proteostasi in questo ambiente richiede chaperoni molecolari extracellulari specifici e i dettagli della proteostasi extracellulare devono ancora essere completamente compresi. Prendi, ad esempio, un chaperone extracellulare, l'alfa 2-macroglobulina (ɑ2M), una proteina plasmatica abbondante. L'ɑ2m punta le proteine difettose e si ipotizza che faciliti la loro eliminazione. Tuttavia, non conosciamo il meccanismo esatto di come ciò accade.
Ora, un team di ricercatori della Università di Chiba, guidato dal dott. Eisuke Itakura, professore associato del Dipartimento di Biologia, ha identificato i substrati che l'ɑ2M punta per la degradazione, e ha pubblicato i risultati il 28 marzo 2023 su Scientific Reports. Hanno anche sviluppato un nuovo saggio che rileva come l'ɑ2m media la degradazione lisosomiale delle proteine puntate.
“Finora non era disponibile alcun metodo quantitativo per rilevare la degradazione lisosomiale delle proteine extracellulari. Pertanto, abbiamo approntato un test di internalizzazione della fluorescenza per misurare la degradazione lisosomiale mediata dall'α2M", afferma il dott. Itakura.
Per realizzare il test, il chaperone α2M è stato marcato con pro-teine di fluorescenza rossa e verde (RFP e GFP, o RG) che possono essere rilevate visivamente all'interno delle cellule. Quando l'α2M-RG è stato interiorizzato nei lisosomi, si è rilevata la fluorescenza di RFP, ma non di GFP. Questo è perché GFP è soggetto a degradazione lisosomiale, ma la RFP è abbastanza resistente.
"Quindi, in questo test, se l'α2M induce la degradazione di proteine mal ripiegate, la RFP dovrebbe accumularsi nella cellula, producendo una fluorescenza rossa", spiega il dott. Itakura.
Questi risultati sono stati anche validati nei lisati dei globuli rossi. Il gruppo ha poi sondato il motivo della presenza di più chaperoni extracellulari all'interno del nostro corpo, confrontando le specificità del substrato di α2M e della clusterina, un altro chaperone extracellulare. In precedenza, il gruppo aveva riferito che anche la clusterina ha una parte nella degradazione extra-cellulare di proteine come l'amiloide-beta, la cui aggregazione extracellulare è implicata nel MA.
Il gruppo ha scoperto che mentre α2M e clusterina avevano funzioni sovrapposte, i loro percorsi non erano ridondanti. Hanno visto che l'α2M riconosce le proteine difettose più inclini all'aggregazione. Secondo i ricercatori, questa scoperta è coerente con la teoria secondo cui una serie di chaperoni extracellulari collabora per proteggerci dallo spettro delle proteine mal ripiegate che si trovano nel corpo.
Ma quali sono le implicazioni a lungo termine di questo lavoro? Il dott. Itakura afferma:
"In futuro, eliminare il meccanismo molecolare della degradazione delle proteine da parte dei chaperoni extracellulari può rivelarsi utile nel trattamento delle malattie correlate, come il MA. Degradando e rimuovendo le proteine anormali che si accumulano all'esterno delle cellule, i chaperoni extracellulari hanno il potenziale per essere uno strumento terapeutico prezioso".
"Se si può determinare una relazione più dettagliata tra chaperoni extracellulari e malattie, potrebbe essere possibile prevedere le condizioni di un individuo e la probabilità di sviluppare una particolare malattia attraverso esami del sangue".
Fonte: Chiba University (> English) - Traduzione di Franco Pellizzari.
Riferimenti: A Tomihari, ...[+2], E Itakura. Alpha 2-macroglobulin acts as a clearance factor in the lysosomal degradation of extracellular misfolded proteins. Scientific Reports, Mar 2023, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.














 Associazione Alzheimer OdV
Associazione Alzheimer OdV