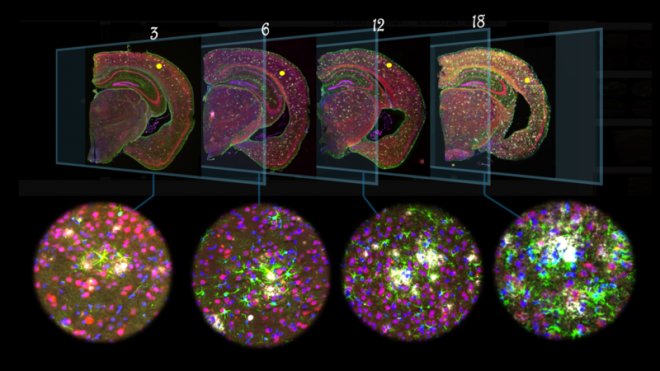
 Nel cervello di topi transgenici di 3, 6, 12 e 18 mesi di età, le placche amiloidi (bianco) provocano una risposta dagli astrociti (verde), un tipo specifico di cellule cerebrali.
Nel cervello di topi transgenici di 3, 6, 12 e 18 mesi di età, le placche amiloidi (bianco) provocano una risposta dagli astrociti (verde), un tipo specifico di cellule cerebrali.
Il cervello di persone con il morbo di Alzheimer (MA) è pieno di placche: aggregati proteici che consistono principalmente di amiloide-beta (Aβ). Nonostante decenni di ricerca, il reale contributo di queste placche al processo della malattia non è ancora chiaro.
Un gruppo di ricerca guidato da Bart De Strooper e Mark Fiers del VIB-KU Leuven Center for Brain & Disease Research di Leuven, in Belgio, ha usato tecnologie pionieristiche per studiare in dettaglio ciò che accade alle cellule cerebrali nelle immediate vicinanze delle placche.
Le sue scoperte, pubblicate sulla rivista Cell, dimostrano che i diversi tipi di cellule del cervello lavorano insieme per montare una risposta complessa alle placche amiloidi, che è probabilmente protettiva in un primo momento, ma in seguito danneggia il cervello.
Il ruolo delle placche amiloidi nel MA ha lasciato perplessi gli scienziati fin da quando Alois Alzheimer per primo le ha descritte nel cervello di una donna con demenza ad esordio precoce. Ora, più di un secolo più tardi, abbiamo imparato molto sui processi molecolari che portano alla neurodegenerazione e alla conseguente perdita di memoria, ma il rapporto tra le placche e il processo di malattia nel cervello è ancora ambiguo.
“Le placche amiloidi potrebbero scatenare oppure guidare la malattia, e l'accumulo di Aβ nel cervello probabilmente inizia un complesso processo multicellulare neurodegenerativo”, dice il prof. Bart De Strooper (VIB-KU Leuven). Il suo gruppo si è proposto di mappare i cambiamenti molecolari che avvengono nelle cellule attorno alle placche amiloidi.
“Abbiamo usato le tecnologie più recenti per analizzare i cambiamenti del genoma a livello trascrittomico indotti dalle placche amiloidi in centinaia di piccoli domini di tessuto”, spiega Mark Fiers, coautore senior dello studio. “In questo modo, abbiamo generato un grande insieme di dati dei cambiamenti trascrizionali che si verificano in risposta alla crescita della patologia amiloide, nel cervello sia di topo che umano”.
Due reti di co-espressione
In un topo modello ben studiato di patologia amiloide, gli scienziati hanno identificato due nuove reti co-esprimenti geni, che apparivano molto sensibili alla deposizione di Aβ.
“Ci siamo concentrati sui cambiamenti trascrittomici nelle immediate vicinanze delle placche amiloidi, con un perimetro di 50 micrometri”, spiega Wei-Ting Chen, postdottorato del gruppo di De Strooper. “Con l'aumento della deposizione di Aβ, è iniziata una risposta pluricellulare di geni co-espressi, che comprendeva non meno di 57 geni indotti dalla placca”.
Questi geni si sono espressi principalmente negli astrociti e nelle microglia, due tipi di cellule cerebrali di supporto, e non erano co-espressi in assenza di placche amiloidi.
“Abbiamo anche trovato alterazioni interessanti in una seconda rete, espressa principalmente da un altro tipo di cellule, ovvero gli oligodendrociti”, aggiunge Ashley Lu, dottoranda del gruppo. “Questa rete genetica si attivava con uno stress amiloide lieve, ma si esauriva in microambienti con elevato accumulo di amiloide”.
“Molti dei geni di entrambe le reti mostrano alterazioni simili nei campioni di cervello umano, rafforzando le nostre osservazioni”, aggiunge Fiers.
Puntare le placche
“I nostri dati dimostrano che le placche amiloidi non sono spettatori innocenti della malattia, come è stato a volte suggerito, ma inducono realmente una risposta forte e coordinata di tutti i tipi di cellule circostanti”, dice De Strooper.
“È necessario altro lavoro per capire se, e quando, la rimozione delle placche amiloidi (ad esempio con la terapia con anticorpi ora in sviluppo per trattare le placche amiloidi) è sufficiente per invertire questi processi cellulari in atto”.
Rimane anche da determinare se un anticorpo che si lega alle placche amiloidi potrebbe modulare queste risposte gliali. “Non farebbe in ogni caso che complicare l'interpretazione dei risultati degli studi clinici, perché questi effetti cellulari potrebbero essere diversi tra i diversi anticorpi”, aggiunge De Strooper.
Fonte: VIB.be (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Wei-Ting Chen, Ashley Lu, Katleen Craessaerts, Benjamin Pavie, Carlo Sala Frigerio, Nikky Corthout, Xiaoyan Qian, Jana Laláková, Malte Kühnemund, Iryna Voytyuk, Leen Wolfs, Renzo Mancuso, Evgenia Salta, Sriram Balusu, An Snellinx, Sebastian Munck, Aleksandra Jurek, Jose Fernandez Navarro, Takaomi C. Saido, Inge Huitinga, Joakim Lundeberg, Mark Fiers, Bart De Strooper. Spatial Transcriptomics and In Situ Sequencing to Study Alzheimer’s Disease. Cell, 22 July 2020, DOI
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.













 Associazione Alzheimer OdV
Associazione Alzheimer OdV