
Per cucinare una frittata, devi mescolare un uovo, che non potrà più essere ricostruito, perché l'uovo subisce una serie di cambiamenti fisiologici e chimici durante la cottura, che causano la rottura dei suoi legami chimici e l'aggregazione delle sue proteine, la loro ristrutturazione e il loro inserimento in una nuova forma definitiva e irreversibile.
Tuttavia, un nuovo studio dell'Università di Tel Aviv ha individuato per la prima volta una nuova forma di aggregazione proteica che è sia reversibile che con conseguenze fisiologiche positive per le cellule. La scoperta potrebbe portare a nuove terapie per condizioni neurodegenerative come l'Alzheimer, il Parkinson e la malattia della 'mucca pazza'.
Lo studio è stato guidato dal Prof. Martin Kupiec e condotto dal Dr. Kobi Simpson-Lavy, entrambi della Facoltà di Biologia Cellulare Molecolare e di Biotecnologie della Tel Aviv University, e pubblicato sulla rivista Molecular Cell.
Come 'de-grumare' una proteina
"La maggior parte delle funzioni all'interno delle nostre cellule sono svolte da proteine, ma quando queste proteine si aggregano producono un 'grumo' che le rende inattive", dice il professor Kupiec. "L'aggregazione delle proteine tende ad aumentare con l'età e porta a una serie di malattie umane, in particolare quelle che portano alla neurodegenerazione".
"Inoltre, quando le proteine adottano una configurazione errata - quando si ripiegano in modo sbagliato - le cellule tentano di separare i grumi o ad accumularli in particolari punti della cella per minimizzarne l'effetto tossico", afferma il dott. Simpson-Lavy . "Questo processo è stato collegato allo sviluppo di una serie di condizioni neurodegenerative, come l'Alzheimer, il Parkinson e la malattia della «mucca pazza»".
Il nuovo studio esamina un tipo completamente diverso di aggregazione delle proteine, che può darci un nuovo meccanismo con cui regolare l'attività dei geni in base ai cambiamenti nell'ambiente cellulare.
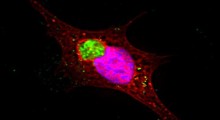
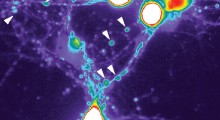
La ricerca è emersa per caso. Mentre il dott. Simpson-Lavy stava studiando il metabolismo degli zuccheri nelle cellule di lievito, ha notato che una versione marcata della proteina che stava osservando (la Std1) formava una chiazza luminosa fuori del nucleo della cellula ogni volta che veniva aggiunto glucosio alle cellule.
In altre parole, la Std1, che è presente di solito nel nucleo delle cellule, dove risiede il genoma, finiva in un'aggregazione al di fuori del nucleo.
"Ci chiedevamo se questa aggregazione proteica sarebbe cambiata in base alle diverse condizioni nel microambiente della cellula", dice il Prof. Kupiec. "E infatti, quando le condizioni sono cambiate di nuovo e il glucosio si è esaurito, l'aggregato si è dissolto e la proteina Std1 è apparsa di nuovo nel nucleo. La Std1 ha un ruolo nel rispondere a zuccheri diversi nell'ambiente di crescita, quindi l'aggregazione reversibile e la dissoluzione della Std1 permette alla cellula di rispondere rapidamente a diversi livelli di abbondanza di zucchero".
Va bene, e anche male, per te
Lo studio suggerisce anche che non tutti gli aggregati proteici sono 'negativi per te'. Alcuni hanno importanti ruoli fisiologici e normativi. Secondo lo studio, i 'chaperoni molecolari' (ciceroni, guide) che hanno dimostrato di alimentare molte malattie neurodegenerative potrebbero avere avuto inizialmente il compito di regolare l'accumulo di proteine non patologiche.
"Questi risultati potrebbero aprire la strada a possibili trattamenti futuri per trasformare l'aggregazione da irreversibile a reversibile", dice il professor Kupiec. "Se riusciamo a scoprire come trasformare un'aggregazione irreversibile in una reversibile, potremmo trattare le malattie neurodegenerative e invertire l'effetto degli aggregati. In altre parole, potrebbe essere ancora possibile ricostruire un uovo da una frittata".
I ricercatori stanno attualmente esaminando perché la stessa proteina si comporta in modo diverso in condizioni diverse.
Fonte: American Friends of Tel Aviv University (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Kobi Simpson-Lavy, Tianchang Xu, Mark Johnston, Martin Kupiec. The Std1 Activator of the Snf1/AMPK Kinase Controls Glucose Response in Yeast by a Regulated Protein Aggregation. Molecular Cell, 2017; DOI: 10.1016/j.molcel.2017.11.016
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali colelgamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.






 Associazione Alzheimer OdV
Associazione Alzheimer OdV