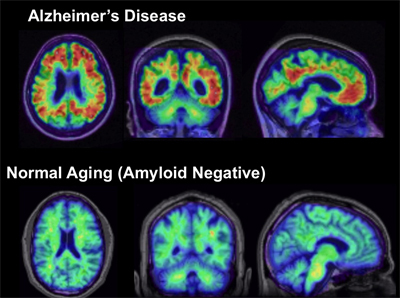
 Scansioni con marcatura dell'amiloide di un cervello con Alzheimer (in alto) e di uno che invecchia nomalmente (in basso).
Scansioni con marcatura dell'amiloide di un cervello con Alzheimer (in alto) e di uno che invecchia nomalmente (in basso).
Una ricerca recente pubblicata su Frontiers in Aging Neuroscience, i Dott. Della David e Frank Baumann, insieme ai loro team del Centro Tedesco Malattie Neurodegenerative e dell'Hertie Institute, hanno dimostrato che i cambiamenti nelle proteine associati all'invecchiamento sono implicati direttamente nelle formazioni proteiche collegate di solito all'Alzheimer.
Le malattie neurodegenerative sono spesso associate ad aggregati di proteine. Questi sono raggruppamenti di proteine che si creano quando le proteine misfolded (mal ripiegate, che hanno perso la forma elaborata, ma riconoscibile, che detta la loro funzione) si aggregano, formando una struttura altamente intrattabile. Recenti ricerche hanno dimostrato che, anche in assenza di malattia, le proteine possono aggregarsi sempre di più con l'età.
Nel caso dei pazienti affetti da Alzheimer, i ricercatori hanno esaminato se gli aggregati di amiloide-beta (Aβ), strettamente associati alla malattia, potrebbero essere indotti dal seme dell'invecchiamento: proteine che si aggregano con l'età per formare aggregati.
Ciò si verificherebbe attraverso un fenomeno ipotizzato chiamato cross-seeding (seminazione incrociata), dove aggregati diversi di proteine possono indurre l'aggregazione l'una dell'altra. Non è un caso che i pochi esempi esistenti di cross-seeding si verifichino tra le proteine associate alle malattie.
Gli esperimenti dello studio sul verme C. elegans, un organismo il cui numero limitato di cellule e la relativa complessità rendono soggetto di test ideale, hanno dimostrato che gli aggregati di proteine dipendenti dall'età possono indurre aggregazione dell'Aβ in vitro e che gli aggregati proteici da età di vecchi campioni di C. elegans avevano un probabilità particolarmente alta di cross-seed degli aggregati Aβ.
Al fine di verificare l'applicabilità di questi risultati ai mammiferi, sono stati effettuati gli stessi test in vitro su estratti cerebrali di topi di varie età, con risultati simili.
Eseguendo un conteggio proteico mediante spettrometria di massa del C. elegans, lo studio ha anche individuato alcune proteine per ulteriori indagini. I candidati più promettenti per l'attività di cross-seeding sono le proteine presenti come componenti minori negli aggregati associati alle malattie, che si aggregano sempre più dopo l'età media.
Inoltre, i ricercatori hanno dimostrato che una di queste proteine inclini all'aggregazione, la PAR-5, può indurre tossicità da Aβ in vivo. Secondo i tassi di paralisi, la sovra-espressione contemporanea di PAR-5 e Aβ accelera la tossicità di Aβ nel C. elegans.
Questi esperimenti, combinati con la spettrometria di massa, evidenziano ulteriormente che certi componenti minori possono essere qualificati come proteine che "potrebbero essere più inclini ad aggregarsi in regioni cerebrali specifiche e aiutare così la generazione e la diffusione di semi associati alla malattia in certi circuiti del cervello".
Questo studio prevede quindi che i cambiamenti nelle conformazioni proteiche associate con la vecchiaia possano avviare l'Alzheimer attraverso l'aggregazione e la tossicità dell'Aβ.
Dato che gli esami in vitro dello studio non possono imitare l'intera complessità del cervello e descrivere tutte le interazioni neurobiologiche, i ricercatori incoraggiano una "valutazione in vivo mediante iniezione di aggregati dipendenti dall'età in modelli pre-sintomatici di topi transgenici di Alzheimer".
E aggiungono che le proteine aggreganti dovrebbero essere mappate in campioni cerebrali umani sia sani che neurodegenerativi, in modo da chiarire "quali semi d'invecchiamento devono essere considerati e se certi semi d'invecchiamento sono più inclini a inseminare o ad associarsi a tipi specifici di malattia in aree anatomiche specifiche".
Fonte: Frontiers in Aging Neuroscience via ScienceDaily (> English text) - Traduzione di Franco Pellizzari.
Reference: Nicole Groh, Anika Bühler, Chaolie Huang, Ka Wan Li, Pim van Nierop, August B. Smit, Marcus Fändrich, Frank Baumann, Della C. David. Age-Dependent Protein Aggregation Initiates Amyloid-β Aggregation. Frontiers in Aging Neuroscience, 2017; 9 DOI: 10.3389/fnagi.2017.00138
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.













 Associazione Alzheimer OdV
Associazione Alzheimer OdV