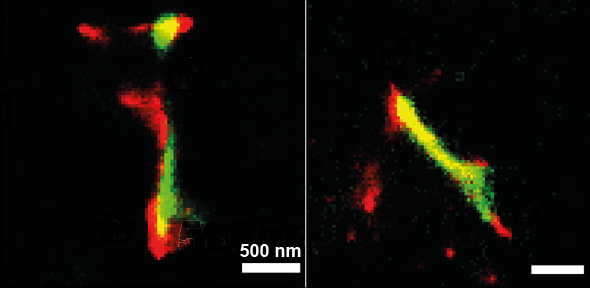
 Immagine a super-risoluzione delle fibrille all'interno del neurone formate da fibrille 'seme' esogene (verde) allungate da α-sinucleina endogena (rosso). Fonte: Dorothea Pinotsi
Immagine a super-risoluzione delle fibrille all'interno del neurone formate da fibrille 'seme' esogene (verde) allungate da α-sinucleina endogena (rosso). Fonte: Dorothea Pinotsi
Dei ricercatori hanno usato un metodo non invasivo per osservare su scala nanometrica come si sviluppa il processo che porta al Parkinson, e hanno identificato il punto del processo in cui le proteine nel cervello diventano tossiche, determinando infine la morte delle cellule cerebrali.
I risultati suggeriscono che la stessa proteina può causare gli effetti tossici che portano alla morte delle cellule cerebrali, o proteggere da essi, a seconda della forma strutturale specifica che prende, e che gli effetti tossici insorgono quando c'è uno squilibrio del livello della proteina nella sua forma naturale in una cella.
Il lavoro potrebbe aiutare a svelare come e perché le persone sviluppano il Parkinson, e aiutare la ricerca di potenziali trattamenti. Lo studio è pubblicato su Proceedings of the National Academy of Sciences. Con la microscopia a super-risoluzione, i ricercatori dell'Università di Cambridge sono riusciti a osservare il comportamento dei diversi tipi di alfa-sinucleina, una proteina strettamente associata al Parkinson, per trovare come danneggia i neuroni, e in quale momento diventa tossica.
Il Parkinson è una delle malattie neurodegenerative causate dal ripiegamento in forma errata di proteine naturali e dal loro raggrupparsi con altre proteine, formando infine strutture sottili simili a filamenti, chiamate «fibrille amiloidi». Questi depositi amiloidi di aggregati di alfa-sinucleina, chiamati anche «corpi di Lewy», sono il segno distintivo del Parkinson.
La malattia di Parkinson è la seconda malattia neurodegenerativa più diffusa in tutto il mondo (dopo l'Alzheimer) interessando quasi 130.000 persone nel Regno Unito, e più di sette milioni in tutto il mondo. I sintomi includono tremori muscolari, rigidità e difficoltà a camminare. La demenza è comune nelle fasi avanzate della malattia.
"Quello che non era ancora chiaro è se una volta che si sono formate, le fibrille di alfa-sinucleina sono ancora tossiche per la cellula", ha detto la dott.ssa Dorotea Pinotsi del Dipartimento di Ingegneria Chimica e Biotecnologie, prima autrice della ricerca di Cambridge.
La Pinotsi e i suoi colleghi del Dipartimento di Ingegneria Chimica e Biotecnologie e del Dipartimento di Chimica dell'Università di Cambridge, guidati dal dottor Gabriele Kaminski Schierle, hanno usato tecniche ottiche a 'super-risoluzione' per esaminare i neuroni viventi senza danneggiare il tessuto. "Ora possiamo vedere come crescono nel tempo le proteine associate alle malattie neurodegenerative, e come queste proteine si uniscono e sono trasmesse alle cellule vicine", ha detto la Pinotsi.
I ricercatori hanno usato diverse forme di alfa-sinucleina e hanno osservato il loro comportamento nei neuroni di ratti. Essi sono stati quindi in grado di correlare ciò che hanno visto con la quantità di tossicità che era presente, scoprendo che, se aggiungono fibrille alfa-sinucleina ai neuroni, queste interagiscono con la proteina alfa-sinucleina che c'è già nella cellula (e che non aveva provocato effetti tossici).
"Si pensava che le fibrille amiloidi che attaccano la proteina sana nella cellula fossero tossiche per la cellula", ha detto la Pinotsi. "Ma quando abbiamo aggiunto una forma solubile diversa di alfa-sinucleina, non ha interagito con la proteina che era già presente nel neurone, ed è interessante notare che questo era dove abbiamo visto gli effetti tossici e dove le cellule hanno cominciato a morire. Così, in qualche modo, questo effetto tossico è insorto quando abbiamo aggiunto la proteina solubile. Il danno sembra che fosse già fatto prima ancora che si formassero le fibrille visibili".
I ricercatori hanno poi osservato che, aggiungendo la forma solubile di alfa-sinucleina insieme alle fibrille amiloidi, l'effetto tossico della prima è stato superato. Sembrava che le fibrille amiloidi agissero come magneti per la proteina solubile e prosciugavano la piscina della proteina solubile, schermandola dagli effetti tossici associati.
"Questi risultati cambiano il modo di guardare la malattia, perché il danno al neurone può avvenire anche quando c'è solo della proteina supplementare solubile nella cellula; è la quantità in eccesso di questa proteina che sembra causare gli effetti tossici che portano alla morte delle cellule cerebrali", ha detto la Pinotsi. La presenza di proteina solubile supplementare può essere indotta da fattori genetici o dall'invecchiamento, anche se c'è qualche evidenza che potrebbe anche essere causata da un trauma alla testa.
La ricerca dimostra quanto sia importante capire appieno i processi in atto che stanno dietro le malattie neurodegenerative, in modo da puntare la fase giusta nel processo. "Con queste tecniche ottiche a super-risoluzione, possiamo realmente vedere dettagli che non potevamo vedere prima, quindi potremmo riuscire a contrastare questo effetto tossico nella fase iniziale", ha detto la Pinotsi.
*****
La ricerca è stata finanziata dal Medical Research Council, dal Engineering and Physical Sciences Research Council, e dal Wellcome Trust.
Fonte: University of Cambridge (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Dorothea Pinotsi et. al. Nanoscopic insights into seeding mechanisms and toxicity of α-synuclein species in neurons. Proceedings of the National Academy of Sciences, 2016 DOI: 10.1073/pnas.1516546113
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.









 Associazione Alzheimer OdV
Associazione Alzheimer OdV