 La struttura a “S” del triplo strato beta dell'amiloide beta-42I ricercatori della University of Illinois di Chicago hanno determinato la struttura molecolare di una delle proteine nelle fibre fini delle placche cerebrali che sono un segno distintivo dell'Alzheimer.
La struttura a “S” del triplo strato beta dell'amiloide beta-42I ricercatori della University of Illinois di Chicago hanno determinato la struttura molecolare di una delle proteine nelle fibre fini delle placche cerebrali che sono un segno distintivo dell'Alzheimer.
Questa molecola, chiamata amiloide-beta-42, è tossica per le cellule nervose e si crede che provochi la cascata della malattia.
Lo studio è online sulla rivista Nature Structural and Molecular Biology.
Conoscere la struttura fisica della forma lunga dell'aminoacido-42 di amiloide-beta nelle fibre è la chiave per capire perchè si piega in modo improprio e si aggrega in placche tossiche, dice Yoshitaka Ishii, professore di chimica della UIC e ricercatore senior dello studio.
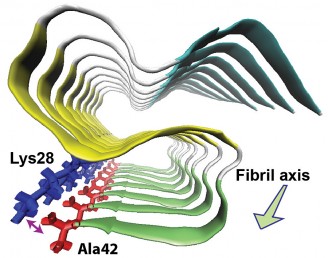
Ishii ed i suoi colleghi hanno scoperto che l'amiloide-beta-42 nelle fibrille amiloidi forma tre strutture piane (chiamate foglietti beta) che si piegano avanti e indietro, formando uno strato sopra l'altro con uno schema a "S". Hanno anche scoperto che l'amminoacido finale sulla proteina forma un «ponte salino» con un aminoacido alla prima curva delle S, stabilizzando la struttura. Un ponte salino è un legame tra molecole, o parti di una molecola, a carica positiva con quelle a carica negativa.
La struttura 3-D è molto diversa da quella dell'amiloide-beta-40, una proteina chimicamente simile e più abbondante, anch'essa legata all'Alzheimer. L'amiloide-beta-40 manca dell'amminoacido finale che porta la carica negativa necessaria per formare il ponte salino.
"Questo spiega perché l'amiloide-beta-42 non interagisce con l'amiloide-beta-40, o la recluta nelle placche che sono tossiche per le cellule nervose", ha detto Ishii.
Le caratteristiche strutturali e il comportamento di piegatura dell'amiloide-beta-42 "offrono una nuova prospettiva sulla propagazione dell'amiloide nell'Alzheimer e, forse, in altre malattie neurodegenerative", ha detto Ishii. I farmaci progettati per agire contro l'amiloide-beta-40, ha detto, "non possono funzionare bene contro l'amiloide-beta-42 più tossica".
La natura chimica dell'amiloide-beta-42, soprattutto la sua estrema avversione all'acqua, ha rappresentato una sfida formidabile per i chimici e i biologi strutturali, ha detto Ishii. "Ci sono una serie di laboratori che hanno lavorato su questo problema, e sono molto orgoglioso del lavoro del mio studente laureato Yiling Xiao nel chiarire la sua struttura". Xiao è il primo autore dello studio.
Fonte: Jeanne Galatzer-Levy in University of Illinois at Chicago (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Yiling Xiao, Buyong Ma, Dan McElheny, Sudhakar Parthasarathy, Fei Long, Minako Hoshi, Ruth Nussinov & Yoshitaka Ishii. Aβ(1–42) fibril structure illuminates self-recognition and replication of amyloid in Alzheimer's disease.Nature Structural & Molecular Biology (2015) doi:10.1038/nsmb.2991
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.














 Associazione Alzheimer OdV
Associazione Alzheimer OdV