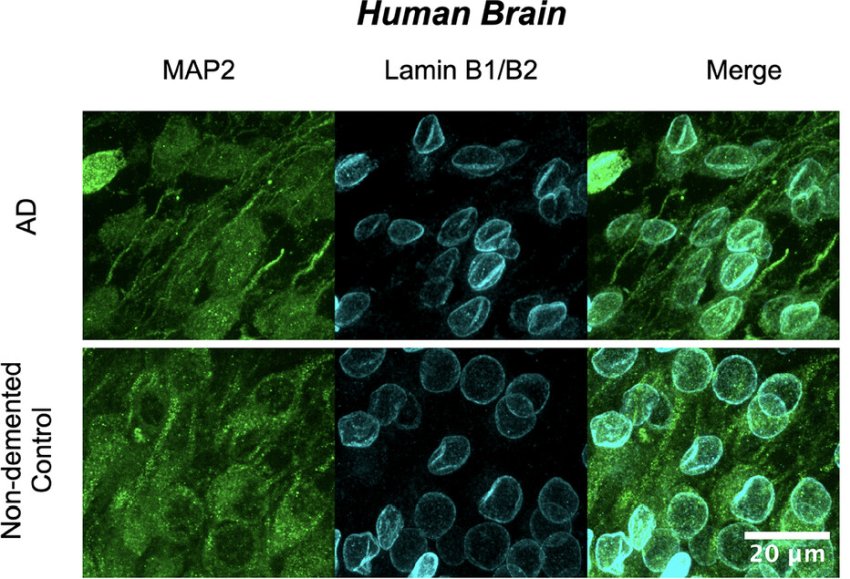
 Invaginazione della lamina nucleare nei neuroni di Alzheimer (AD) del lobo corticale umano (temporale con ippocampo). Fonte: Sun et al.
Invaginazione della lamina nucleare nei neuroni di Alzheimer (AD) del lobo corticale umano (temporale con ippocampo). Fonte: Sun et al.
Ricercatori del morbo di Alzheimer (MA) dell'Università della Virginia hanno scoperto che proteine tau nocive danneggiano le istruzioni operative essenziali per le nostre cellule cerebrali, una scoperta che potrebbe portare a nuovi trattamenti. La proteina tau tossica, secondo lo studio pubblicato su Alzheimer's & Dementia, deforma la forma del nucleo delle cellule nervose (neuroni), alterando la funzione dei geni contenuti al loro interno e riprogrammando le cellule per produrre più tau.
Nonostante la proteina sia da tempo un sospetto principale del MA e di altre 'taupatie' neurodegenerative, la nuova ricerca di George Bloom dell'UVA e dei suoi collaboratori, è tra le prime a identificare i danni fisici concreti che la tau provoca ai neuroni. Questi risultati offrono ai ricercatori indizi entusiasmanti per sviluppare nuovi trattamenti per il MA e le taupatie, che ora non sono trattabili.
“Sono state condotte molte fantastiche ricerche da altri laboratori", ha affermato Bloom, dei dipartimenti di biologia, biologia cellulare e neuroscienze della UVA, nonché dell'UVA Brain Institute, del Virginia Alzheimer's Disease Center e del programma UVA di neuroscienze fondamentali. “La tau tossica descritta qui è effettivamente rilasciata dai neuroni, quindi se riusciamo a capire come intercettarla con anticorpi o altri farmaci quando fluttua nel cervello al di fuori dei neuroni, potremmo rallentare o fermare la progressione del MA e delle altre taupatie".
Alzheimer e taupatie
Le taupatie sono caratterizzate dall'accumulo di tau all'interno del cervello. Il MA è una taupatia ben nota, ma ce ne sono molte altre, come la degenerazione lobare frontotemporale, la paralisi sopra-nucleare progressiva e l'encefalopatia traumatica cronica.
Queste malattie si presentano in genere come demenza, cambiamenti di personalità e/o problemi di movimento. Non ci sono trattamenti disponibili per le taupatie non-MA e i ricercatori dell'UVA erano ansiosi di comprendere meglio cosa sta accadendo, per arrivare al modo di prevenirle o trattarle.
Bloom e il suo team hanno scoperto che gli 'oligomeri' di tau - assemblaggi di più proteine tau - possono avere effetti drammatici sulla forma normalmente liscia del nucleo neuronale. Gli oligomeri causano la piegatura del nucleo su se stesso ('invaginazione'), rompendo il materiale genetico contenuto all'interno. La posizione fisica e la disposizione dei geni influenzano il modo in cui lavorano, quindi questo rimaneggiamento innaturale può avere effetti terribili.
"La nostra scoperta, che gli oligomeri di tau alterano la forma del nucleo, ci ha spinto al passo successivo, testare l'idea che i cambiamenti nell'espressione genica siano causati dal cambiamento di forma del nucleo", ha detto Bloom. "Questo è esattamente ciò che abbiamo visto per molti geni e il più grande cambiamento è che il gene della stessa tau aumenta la sua espressione di quasi 3 volte. Così la tau cattiva potrebbe causare la produzione di più tau cattiva dai neuroni, sarebbe come una palla di neve che rotola in discesa".
I ricercatori hanno scoperto che i pazienti con MA avevano il doppio dei nuclei invaginati rispetto alle persone senza la condizione. Hanno osservato anche aumenti nei topi di laboratorio usati come modello di MA e di un'altra taupatia.
I ricercatori affermano che ulteriori ricerche su come avviene questo processo potrebbero aprire la porta a nuovi modi per prevenire e trattare il MA e altre taupatie.
Fonte: University of Virginia (> English) - Traduzione di Franco Pellizzari.
Riferimenti: X Sun, [+11], GS Bloom. Structural and functional damage to neuronal nuclei caused by extracellular tau oligomers. Alz & Dem., Dec 2023, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.











 Associazione Alzheimer OdV
Associazione Alzheimer OdV