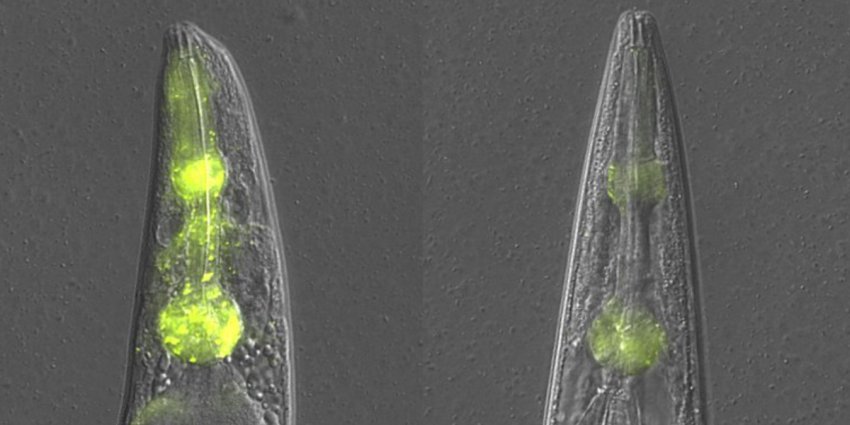
 Testa di 2 vermi C.elegans, con aggregati proteici visibili nella faringe in condizioni di controllo (fluorescenza gialla, a sinistra) e senza aggregati per la pulizia eseguita dal meccanismo SAPA (a destra).
Testa di 2 vermi C.elegans, con aggregati proteici visibili nella faringe in condizioni di controllo (fluorescenza gialla, a sinistra) e senza aggregati per la pulizia eseguita dal meccanismo SAPA (a destra).
I ricercatori dell'Istituto Babraham di Cambridge (GB) e del Centro tedesco per le malattie neurodegenerative (DZNE) hanno identificato un meccanismo di supporto al controllo della qualità delle proteine che impedisce gli effetti tossici dell'aggregazione proteica in tessuti specifici quando falliscono i normali metodi di monitoraggio molecolare.
Comprendendo come i diversi tessuti affrontano l'accumulo di proteine, questa ricerca potrebbe accelerare l'identificazione di modi per proteggere i tessuti vulnerabili all'accumulo di proteine, magari affrontando sia gli aggregati di proteine associati alla malattia che quelli dipendenti dall'età che accelerano il declino funzionale dei tessuti.
Proprio come le fabbriche identificano oggetti difettosi che escono dalla linea di produzione, le cellule usano meccanismi diversi per monitorare la produzione, la piegatura e l'accumulo di proteine. Durante l'invecchiamento alcune proteine diventano inclini all'accumulo a causa del loro ripiegamento errato e del declino dei loro meccanismi di controllo della qualità. I ciuffi proteici chiamati aggregati causano problemi per il normale funzionamento dell'organismo.
Questo aumento dell'accumulo di proteine non è distribuito uniformemente in tutto il corpo e alcuni tessuti hanno maggiori probabilità di accumulare aggregati rispetto ad altri; ad esempio le placche amiloidi che si accumulano nel cervello nell'Alzheimer. È tuttora poco chiaro cosa guida la vulnerabilità o la resistenza specifica di ogni tessuto all'aggregazione delle proteine.
Studiando l'accumulo di proteine nel verme nematode C.elegans la dott.ssa Della David e il suo team hanno scoperto che anche quando i meccanismi tipici di controllo della qualità delle proteine erano interrotti, c'erano bassi livelli di aggregazione delle proteine nell'organo nutritivo dei topi invecchiati (la faringe), rispetto alle pareti del corpo.
I loro esperimenti hanno rivelato un meccanismo specifico per tessuto che hanno chiamato 'salvaguardia contro l'aggregazione proteica' (SAPA, safeguard against protein aggregation), che si attiva quando altri meccanismi di controllo della qualità delle proteine sono difettosi. Quando è stato attivato, questo meccanismo ha alleviato la proteotossicità e ha parzialmente ripristinato la funzione faringea.
La dott.ssa Della David, leader del gruppo nel programma di ricerca sulla segnalazione del Babraham Institute, spiega:
“Gli organismi hanno una serie di meccanismi di controllo presenti in tutti i tessuti, che si occupano dell'accumulo di proteine difettose. In questo lavoro abbiamo identificato un nuovo meccanismo di controllo specifico per tessuto.
"Questo meccanismo di sicurezza viene innescato quando i meccanismi di controllo convenzionali sono compromessi e siamo entusiasti della sua scoperta perché rivela un ulteriore livello di protezione che può essere indotto per proteggere i tessuti in tempi di stress, fermando volutamente l'aggregazione proteica e ripristinando la funzione dell'organo".
Ma come viene raggiunta questa specificità? Per prevenire l'aggregazione proprio nella faringe, il meccanismo di sicurezza si basa su un percorso specifico e sottovalutato costituito dal sistema di smaltimento della spazzatura delle cellule chiamato 'degrado lisosomiale indipendente dalla macroautofagia' (macroautophagy-independent lysosomal degradation).
Usa sorprendentemente anche fattori precedentemente non correlati alla gestione dell'aggregazione proteica, ma noti per essere coinvolti nella risposta dell'ospite ad agenti patogeni naturali che colpiscono specificamente il tratto digestivo.
Il team ha continuato scoprendo il modo in cui il meccanismo SAPA impedisce l'accumulo di proteine. Tracciando attentamente la produzione di una proteina aggregata e le dinamiche di aggregazione, il team ha scoperto che il meccanismo recentemente scoperto riconosce ed elimina le proteine appena sintetizzate prima che possano formare grandi aggregati.
La dott.ssa David conclude:
"Un grande enigma nei nostri sforzi per comprendere le malattie neurodegenerative è il motivo per cui particolari aree del cervello mostrano aggregati e altri no. L'esistenza di meccanismi protettivi locali potrebbe aiutare a spiegare perché alcune aree cerebrali sono più resistenti all'aggregazione proteica.
"Più ampiamente, la nostra ricerca fondamentale in quest'area è importante per informare gli interventi terapeutici per le malattie dell'aggregazione proteica, nonché i modi per prevenire l'aggregazione proteica indesiderata che avviene con l'età".
Fonte: Babraham Institute (> English) - Traduzione di Franco Pellizzari.
Riferimenti: R Jung, [+10], DC David. A safety mechanism enables tissue-specific resistance to protein aggregation during aging in C. elegans. PLOS Biology, 2023, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.










 Associazione Alzheimer OdV
Associazione Alzheimer OdV