Una ricerca ha rivelato che le placche di proteine associate alla malattia sono più appiccicose di quanto si pensava.
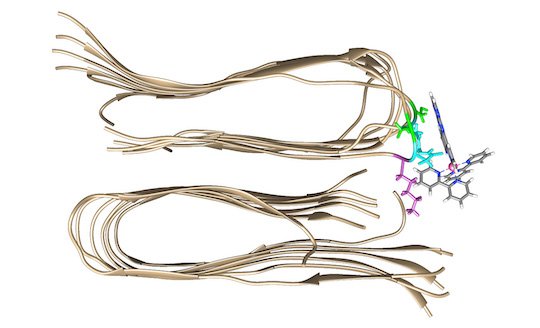 Una molecola di colorante fluorescente si lega a un secondo sito sulla fibrilla della proteina amiloide-beta. (Fonte: Università di Miami)
Una molecola di colorante fluorescente si lega a un secondo sito sulla fibrilla della proteina amiloide-beta. (Fonte: Università di Miami)
Gli scienziati della Rice University stanno usando la durata della fluorescenza (fluorescence-lifetime) per far luce su un peptide associato al morbo di Alzheimer (MA), che secondo stime dei Centri per il Controllo delle Malattie USA interesserà quasi 14 milioni di persone negli Stati Uniti entro il 2060.
Con un nuovo approccio che usa la spettroscopia risolta nel tempo (time-resolved spectroscopy) e la chimica computazionale, Angel Martí e il suo team, in uno studio pubblicato su Chemical Science hanno trovato prove sperimentali di un sito di legame alternativo sugli aggregati di amiloide-beta (Aβ). I depositi di placca amiloide nel cervello sono una delle caratteristiche principali del MA.
Martí, professore di chimica, bioingegneria e scienza dei materiali e nano-ingegneria e direttore di facoltà alla Rice, ha affermato:
"L'Aβ è un peptide che si aggrega nel cervello delle persone che soffrono di MA, formando queste fibre sopramolecolari su nanoscala (fibrille). Una volta che crescono a sufficienza, queste fibrille precipitano e formano quelle che chiamiamo placche amiloidi.
"Comprendere come le molecole in generale si legano all'Aβ è particolarmente importante non solo per lo sviluppo di farmaci che si legheranno con migliore affinità ai suoi aggregati, ma anche per capire chi sono gli altri giocatori che contribuiscono alla tossicità del tessuto cerebrale".
Il gruppo di Martí aveva in precedenza identificato un primo sito di legame per i depositi di Aβ, scoprendo che le molecole metalliche di tintura erano in grado di legarsi alle tasche formate dalle fibrille. La capacità delle molecole di essere fluorescenti (emettere luce se eccitate sotto uno spettroscopio) ha indicato la presenza del sito di legame. Martí spiega:
"La spettroscopia risolta nel tempo, usata nel laboratorio per l'ultima scoperta, è una tecnica sperimentale che guarda al tempo trascorso dalle molecole in uno stato eccitato. Eccitiamo la molecola con la luce, la molecola assorbe l'energia dai fotoni di luce e arriva a uno stato eccitato, uno stato più energico.
"Questo stato energizzato è responsabile del bagliore fluorescente. Possiamo misurare il tempo che le molecole trascorrono nello stato eccitato, che si chiama lifetime (durata di vita), e quindi usiamo tali informazioni per valutare l'equilibrio legante delle piccole molecole con l'Aβ" .
Oltre al secondo sito di legame, il laboratorio e i collaboratori dell'Università di Miami hanno scoperto che diversi coloranti fluorescenti, che non si aspettavano potessero legarsi ai depositi di amiloide, in effetti lo fanno.
"Questi risultati ci consentono di creare una mappa di siti di legame nell'Aβ e un registro delle composizioni di aminoacidi richieste per la formazione di tasche di legame nelle fibrille di Aβ", ha detto Martí.
Il fatto che la spettroscopia risolta nel tempo è sensibile all'ambiente attorno alla molecola di colorante ha permesso a Martí di dedurre la presenza del secondo sito di legame:
“Quando la molecola è libera in soluzione, la sua fluorescenza ha una durata particolare dovuta a questo ambiente. Tuttavia, quando la molecola è legata alle fibre amiloidi, il microambiente è diverso e di conseguenza lo è anche la durata della fluorescenza. Per la molecola legata alle fibre amiloidi, abbiamo osservato due diverse vite di fluorescenza.
“La molecola non si legava a un sito unico nell'Aβ ma a due siti diversi. E questo è estremamente interessante perché i nostri studi precedenti avevano indicato solo un sito di legame. Ciò è accaduto perché non siamo stati in grado di vedere tutti i componenti con le tecnologie in uso a quel tempo".
La scoperta ha suggerito altri esperimenti.
"Abbiamo deciso di esaminare ulteriormente questo, non solo attraverso la sonda che abbiamo progettato, ma anche con altre molecole usate da decenni nella fotochimica inorganica", ha detto. “L'idea era trovare un controllo negativo, una molecola che non si legasse all'Aβ. Ma ciò che abbiamo scoperto è che queste molecole, che non ci aspettavamo si legassero all'Aβ, in realtà si legavano ad essa con un'affinità decente".
Martí ha affermato che i risultati avranno un impatto anche sullo studio di "molte malattie associate ad altri tipi di amiloidi: Parkinson, sclerosi laterale amiotrofica (SLA), diabete di tipo 2, amiloidosi sistemica". Comprendere i meccanismi di legame delle proteine amiloidi è utile anche per studiare gli amiloidi non patogeni e le loro potenziali applicazioni nello sviluppo di farmaci e nella scienza dei materiali.
"Esistono amiloidi funzionali che il nostro corpo e altri organismi producono per diversi motivi, e non sono associati a malattie", ha detto Martí. “Esistono organismi che producono amiloidi che hanno effetti antibatterici. Esistono organismi che producono amiloidi per scopi strutturali, per creare barriere e altri che usano amiloidi per lo stoccaggio chimico. Lo studio degli amiloidi non patogeni è un'area emergente della scienza, quindi questo è un altro percorso che i nostri risultati possono aiutare a sviluppare".
Fonte: Rice University (> English) - Traduzione di Franco Pellizzari.
Riferimenti: B Jiang, ...[+7], AA Martí. Deconvoluting binding sites in amyloid nanofibrils using time-resolved spectroscopy. Chemical Science, 2023, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.










 Associazione Alzheimer OdV
Associazione Alzheimer OdV