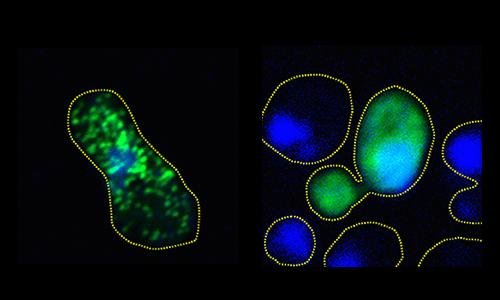
 Sinistra: grumi compatti di FUS verde fluorescente si formano nella cellula del lievito non trattata. Destra: la proteina rimane diffusa e non aggregata nella cellula fosforilata. (Fonte: Monahan et. al.)Degli scienziati riferiscono di un nuovo studio che, imitando un processo naturale delle cellule, ha impedito la formazione di grumi di proteine associati alla sclerosi laterale amiotrofica (ALS) e alla demenza frontotemporale.
Sinistra: grumi compatti di FUS verde fluorescente si formano nella cellula del lievito non trattata. Destra: la proteina rimane diffusa e non aggregata nella cellula fosforilata. (Fonte: Monahan et. al.)Degli scienziati riferiscono di un nuovo studio che, imitando un processo naturale delle cellule, ha impedito la formazione di grumi di proteine associati alla sclerosi laterale amiotrofica (ALS) e alla demenza frontotemporale.
In colture di cellule umane e del lievito, gli scienziati hanno interrotto il raggruppamento dannoso di proteine FUS, esponendole alla fosforilazione, un processo che consente di modificare in modo preciso gli aminoacidi che formano le proteine, aumentando la loro carica elettrica negativa. La ricerca mostra che l'aumento di carica induce le proteine a respingersi quando di norma si aggregano.
I risultati potrebbero avere implicazioni positive per il trattamento dell'ALS - chiamata anche malattia di Lou Gehrig - e della demenza. "Nessuno ha dimostrato che è possibile usare la carica, e la fosforilazione per ottenere la carica, per distruggere questi aggregati proteici associati all'ALS", ha affermato l'autore corrispondente Nicolas Fawzi, assistente professore nel Dipartimento di Farmacologia Molecolare, Fisiologia e Biotecnologie della Brown University.
La fosforilazione avviene nelle cellule di tutto il corpo per vari motivi. Le cellule la eseguono sulle proteine FUS nell'ambito di una sequenza di eventi collegati al danno del DNA. Nel nuovo studio, i ricercatori hanno esaminato la fosforilazione sia naturale che artificiale, sostituendo aminoacidi specifici nelle proteine FUS.
Lo studio, condotto da un team di ricercatori della Brown, della Uniformed Services University, dell'Università Johns Hopkins, dell'Università di Lehigh e dei National Institutes of Health, è apparsa sul Journal EMBO.
Fasi dello studio
Il progetto è iniziato nel laboratorio di Fawzi alla Brown, dove è stata studiata la struttura e la biofisica delle FUS e di proteine simili, strettamente associate alle malattie neurodegenerative. Lui e la co-autrice Veronica Ryan, specializzanda di neuroscienze della Brown, volevano esplorare se e come la fosforilazione può influenzare il modo in cui le proteine FUS si raggruppano, pregiudicando la salute dei neuroni.
La prima cosa da fare era identificare diversi siti di aminoacidi specifici nella regione che le FUS usano per legarsi ad altre proteine, dove l'enzima naturale 'proteina chinasi DNA-dipendente' (DNA-PK) provoca la fosforilazione. I collaboratori dell'Uniformed Services University, compresi i co-autori Zachary Monahan e Frank Shewmaker, hanno continuato il lavoro confermando questi e altri siti di fosforilazione nelle FUS derivate da cellule umane.
Con più di una dozzina di siti identificati, il team ha quindi deciso di imitare il lavoro delle DNA-PK nelle colture di cellule viventi. Il gruppo di Monahan e Shewmaker ha progettato FUS umane nel lievito di birra e ha anche implementato l'imitazione della fosforilazione in una coltura di cellule umane.
Quello che hanno osservato in entrambe le culture è che, aumentando il grado di fosforilazione da soli due siti fino a 12, possono ridurre proporzionalmente la propensione della proteina ad aggregarsi in grumi.
Nelle cellule del lievito hanno mostrato che, quanto più efficacemente si impedisce la completa aggregazione (aggiungendo altri siti che imitano la fosforilazione), tanto più sono robuste le colonie di cellule che crescono. Questa constatazione ha dimostrato che il raggruppamento di FUS è tossico per le cellule.
Ryan, Abigail Janke e i colleghi della Brown hanno dimostrato che la fosforilazione distrugge i contatti tra le molecole di FUS. Nel frattempo, la modellazione computazionale dell'effetto della fosforilazione nella struttura della proteina, condotta dal coautore Jeetain Mittal alla Lehigh, ha dimostrato che è la variazione della carica elettrica che porta alla differenza nella probabilità di aggregazione delle proteine.
Un orizzonte terapeutico
Fawzi ha riconosciuto che l'approccio usato dagli scienziati nel laboratorio non può ancora costituire una terapia pratica per le malattie neurodegenerative, ma ha affermato che la dimostrazione che si può usare la fosforilazione per interrompere l'aggregazione proteica dovrebbe dare la motivazione a lavorare per produrre un trattamento. "Non esiste alcuna terapia o cura per l'ALS e la demenza frontotemporale", ha detto Fawzi. "Quello di cui abbiamo bisogno sono nuove ipotesi e nuovi angoli".
Fawzi ha ipotizzato che, poiché la fosforilazione è un processo naturale delle cellule, la chiave può essere trovare un "interruttore" per attivarla quando è necessario. Ha anche notato che molte aziende farmaceutiche hanno gruppi di ricerca molto attivi dedicati allo sfruttamento degli enzimi fosforilanti chiamati chinasi, come il DNA-PK.
Si dovrebbe puntare a una terapia futura localizzata nel cervello (in caso di demenza frontotemporale), o focalizzata sui neuroni motori (nel caso di ALS). La fosforilazione di FUS nel corpo in generale potrebbe essere dannosa, dato che si presume che abbiano ruoli importanti nell'aiutare le cellule ad elaborare l'RNA e nella riparazione del DNA.
Per ora la collaborazione è focalizzata sulla sperimentazione della fosforilazione in un modello di malattia neurodegenerativa piuttosto che nelle cellule in generale, ha dichiarato Fawzi.
Fonte: Brown University (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Zachary Monahan, Veronica H Ryan, Abigail M Janke, Kathleen A Burke, Shannon N Rhoads, Gül H Zerze, Robert O'Meally, Gregory L Dignon, Alexander E Conicella, Wenwei Zheng, Robert B Best, Robert N Cole, Jeetain Mittal, Frank Shewmaker, Nicolas L Fawzi. Phosphorylation of the FUS low‐complexity domain disrupts phase separation, aggregation, and toxicity. The EMBO Journal, 2017; e201696394 DOI: 10.15252/embj.201696394
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.











 Associazione Alzheimer OdV
Associazione Alzheimer OdV