Dei ricercatori hanno allungato l'età dei neuroni umani oltre a quello che era possibile finora.
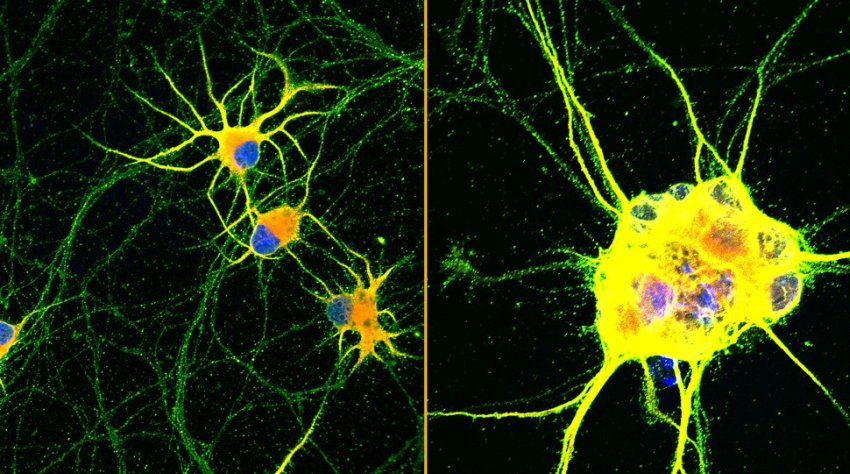 Immagini fluorescenti di neuroni umani (rosso, verde e blu) che crescono su rivestimenti con molecole a movimento rapido (a sinistra) o su laminina convenzionale (a destra) per 60 giorni.
Immagini fluorescenti di neuroni umani (rosso, verde e blu) che crescono su rivestimenti con molecole a movimento rapido (a sinistra) o su laminina convenzionale (a destra) per 60 giorni.
Ricercatori guidati dalla Northwestern University hanno generato i primi neuroni altamente maturi da cellule staminali pluripotenti indotte dall'uomo (IPSC, induced pluripotent stem cells), un'impresa che apre nuove opportunità per la ricerca medica e per potenziali terapie di trapianto per le malattie neurodegenerative e le lesioni traumatiche. Lo studio è stato pubblicato su Cell Stem Cell.
Sebbene ricercatori precedenti abbiano differenziato le cellule staminali perché diventassero neuroni, quei neuroni erano funzionalmente immaturi, assomigliando ai neuroni delle fasi embrionali o post-natali. La maturazione limitata ottenuta con le attuali tecniche di coltura di cellule staminali diminuisce il loro potenziale per gli studi sulle neurodegenerazioni.
Per creare neuroni maturi, il team ha usato 'molecole danzanti' (dancing molecules), una tecnica rivoluzionaria introdotta alla fine del 2021 da Samuel I. Stupp, professore della Northwestern University. Il team ha prima differenziato le IPSC umane in neuroni motori e corticali e poi le ha messe su rivestimenti di nanofibre sintetiche contenenti molecole danzanti in rapido movimento.
I neuroni arricchiti non erano solo più maturi, ma hanno anche dimostrato capacità di segnalazione migliori e una maggiore capacità di ramificazione, che è necessaria ai neuroni per stabilire un contatto sinaptico tra loro. E, a differenza dei neuroni tipici derivati dalle cellule staminali, che tendono a raggrupparsi insieme, questi neuroni non si sono aggregati, rendendoli meno impegnativi da mantenere.
Con ulteriore sviluppo, i ricercatori ritengono che questi neuroni maturi possano essere trapiantati nei pazienti, come terapia promettente per le lesioni del midollo spinale e per le malattie neurodegenerative, comprese la sclerosi laterale amiotrofica (SLA), il Parkinson, l'Alzheimer e la sclerosi multipla.
I neuroni maturi presentano anche nuove opportunità per lo studio delle malattie neurodegenerative come la SLA e altre malattie legate all'età in modelli di colture in vitro. Allungando l'età dei neuroni nelle colture cellulari, i ricercatori potrebbero migliorare gli esperimenti per comprendere meglio le malattie ad esordio tardivo.
"Questa è la prima volta che siamo riusciti a innescare la maturazione funzionale avanzata dei neuroni derivati da IPSC umane, placcandoli su una matrice sintetica", ha dichiarato Evangelos Kiskinis della Northwestern, coautore senior dello studio. "È importante perché ci sono molte applicazioni che richiedono ai ricercatori di usare popolazioni purificate di neuroni. La maggior parte dei laboratori che lavorano con le cellule staminali usa i neuroni di topo o di ratto coltivati insieme a neuroni derivati dalle cellule staminali umane. Ciò non consente agli scienziati di studiare cosa accade nei neuroni umani perché finisci per lavorare con una miscela di cellule di topo e umane".
"Quando hai una IPSC che riesci a trasformare in un neurone, sarà un neurone giovane", ha detto Stupp, coautore senior dello studio. “Ma, perché sia utile terapeuticamente, hai bisogno di un neurone maturo. Altrimenti, è come chiedere a un bambino di svolgere una funzione che richiede un adulto. Abbiamo confermato che i neuroni rivestiti con le nostre nanofibre diventano più mature rispetto ad altri metodi e che i neuroni maturi sono in grado di stabilire meglio le connessioni sinaptiche fondamentali per la funzione neuronale".
Abilità di 'danza' sincronizzata
Per sviluppare i neuroni maturi, i ricercatori hanno usato nanofibre composte da 'molecole danzanti', un materiale che il laboratorio di Stupp ha sviluppato come potenziale trattamento per lesioni acute del midollo spinale. In una ricerca precedente pubblicata su Science, Stupp ha scoperto come sintonizzare il movimento delle molecole, in modo che possano trovare, e interagire correttamente con, i recettori cellulari in costante movimento. Imitando il movimento delle molecole biologiche, i materiali sintetici possono comunicare con le cellule.
Un'innovazione chiave della ricerca di Stupp è stata scoprire come controllare il movimento collettivo di oltre 100.000 molecole all'interno delle nanofibre. Poiché i recettori cellulari nel corpo umano possono muoversi a velocità rapide - a volte con tempi di millisecondi - diventano obiettivi in movimento difficili da colpire.
"Immagina di dividere un secondo in 1.000 periodi di tempo", ha detto Stupp. "Ecco la velocità con cui potrebbero muoversi i recettori. Questi tempi sono così stretti che sono difficili da cogliere".
Nel nuovo studio, Stupp e Kiskinis hanno scoperto che le nanofibre sintonizzate per contenere molecole con il maggior movimento hanno portato a neuroni migliori. In altre parole, i neuroni coltivati su rivestimenti più dinamici - essenzialmente impalcature composte da molte nanofibre - erano anche i neuroni che diventavano più maturi, meno proni ad aggregarsi e con capacità più intense di segnalazione.
"Il motivo per cui pensiamo che funzioni è perché i recettori si muovono molto velocemente sulla membrana cellulare e anche le molecole di segnalazione delle nostre impalcature sono molto rapide", ha detto Stupp. “È più probabile che siano sincronizzati. Se due ballerini non sono sincronizzati, l'accoppiamento non funziona. I recettori vengono attivati dai segnali attraverso incontri spaziali molto specifici. È anche possibile che le nostre molecole in rapido movimento migliorino il movimento del recettore, il che a sua volta le aiuta a raggrupparsi a beneficio della segnalazione".
I neuroni con la firma SLA danno una nuova finestra sulla malattia
Stupp e Kiskinis credono che i loro neuroni maturi possano dare informazioni sulle malattie legate all'invecchiamento e che diventeranno candidati migliori per testare varie terapie farmacologiche nelle colture cellulari. Usando le molecole danzanti, i ricercatori sono riusciti a far diventare i neuroni umani molto più anziani di quanto precedentemente possibile, consentendo agli scienziati di studiare l'insorgenza delle malattie neurodegenerative.
Come parte della ricerca, Kiskinis e il suo team hanno preso le cellule della pelle da un paziente con SLA e le hanno convertite in IPSC specifiche del paziente. Quindi, hanno differenziato quelle cellule staminali in motoneuroni, che è il tipo di cellula afflitto in questa malattia neurodegenerativa.
Infine, i ricercatori hanno coltivato i neuroni sui nuovi materiali di rivestimento sintetico per sviluppare ulteriormente le firme della SLA. Questo non solo ha dato a Kiskinis una nuova finestra sulla SLA, ma questi 'neuroni della SLA' potrebbero anche essere usati per testare potenziali terapie.
“Per la prima volta, siamo riusciti a vedere l'aggregazione di proteine neurologiche ad insorgenza adulta nei motoneuroni del paziente di SLA derivati dalle cellule staminali. Questo rappresenta una svolta per noi", ha detto Kiskinis. "Non è chiaro come l'aggregazione inneschi la malattia. È quello che speriamo di scoprire ora per la prima volta".
Speranza per un trattamento futuro per lesioni del midollo spinale e malattie neurodegenerative
Più avanti, i neuroni maturi derivati da IPSC, e potenziati, potrebbero anche essere trapiantati in pazienti con lesioni del midollo spinale o con malattie neurodegenerative. Ad esempio, i medici potrebbero prendere le cellule della pelle da un paziente con SLA o con Parkinson, convertirle in IPSC e quindi coltivare quelle cellule sul rivestimento per creare neuroni sani e altamente funzionali.
Il trapianto di neuroni sani in un paziente potrebbe sostituire i neuroni danneggiati o persi, ripristinando potenzialmente la cognizione o le sensazioni perse. E, poiché le cellule iniziali provenivano dal paziente, i nuovi neuroni derivati da IPSC dovrebbero corrispondere geneticamente al paziente, eliminando la possibilità di rigetto.
"La terapia sostitutiva delle cellule può essere molto impegnativa per una malattia come la SLA, perché i motoneuroni trapiantati nel midollo spinale dovranno proiettare i loro lunghi assoni sui siti muscolari appropriati in periferia, ma potrebbe essere più semplice per il Parkinson", ha detto Kiskinis. "In entrambi i casi questa tecnologia sarà trasformativa".
"È possibile prendere le cellule da un paziente, trasformarle in cellule staminali e quindi differenziarle in tipi diversi di cellule", ha detto Stupp. “Ma la resa per quelle cellule tende ad essere bassa e arrivare a una corretta maturazione è un grosso problema. Potremmo integrare il nostro rivestimento nella produzione su larga scala di neuroni derivati dal paziente per le terapie di trapianto di cellule senza rigetto immunitario".
Fonte: Amanda Morris in Northwestern University (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Z Álvarez, ...[+15], E Kiskinis. Artificial extracellular matrix scaffolds of mobile molecules enhance maturation of human stem cell-derived neurons. Cell Stem Cell, 2023, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.









 Associazione Alzheimer OdV
Associazione Alzheimer OdV