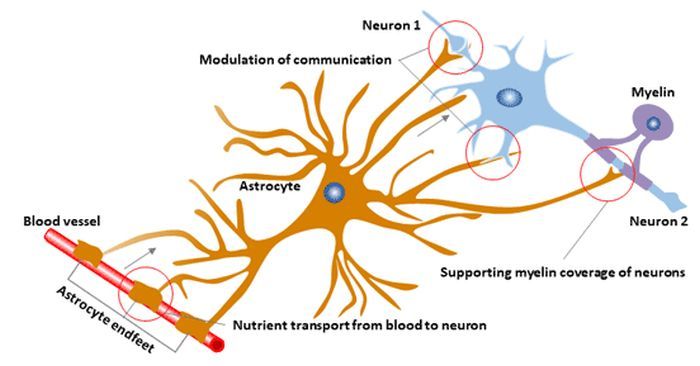
 Un astrocita tra il vaso capillare e il neurone (Fonte: Cusabio)
Un astrocita tra il vaso capillare e il neurone (Fonte: Cusabio)
Aumentare l'espressione di un gene nelle cellule che assistono i neuroni nel cervello protegge i neuroni nei topi modello del morbo di Alzheimer (MA), secondo un nuovo studio pubblicato il 10 gennaio su Nature Communications. Il lavoro è stato guidato dal prof. Jeffrey Johnson della Facoltà di Farmacia della University of Wisconsin-Madison e dai suoi collaboratori dell'Università di Edimburgo in Scozia.
Un'alta attività del gene Nrf2 ha rallentato il declino cognitivo e fisico nei topi e ha ridotto l'accumulo di proteine appiccicose nel loro cervello, tutti indicatori chiave della malattia negli esseri umani. I ricercatori avevano identificato in precedenza l'Nrf2 come bersaglio terapeutico per il Parkinson e per la sclerosi laterale amiotrofica (SLA). Stanno ora cercando i modi per aumentare l'attività dell'Nrf2 come potenziale terapia per il MA, che ha pochi buoni trattamenti e nessuna cura.
Il team della UW-Madison ha scoperto che l'aumento dei livelli di Nrf2 nelle cellule di supporto chiamate astrociti, ha aiutato i neuroni a ridurre notevolmente l'accumulo di due proteine disordinate che sono al cuore del MA. Queste proteine, tau e amiloide-beta (Aβ), formano grumi pericolosi chiamati grovigli e placche, rispettivamente. L'accumulo di queste proteine stressa i neuroni e rovina i loro macchinari, portando alla morte dei neuroni e al declino cognitivo.
I topi che sovra-esprimono Nrf2 hanno avuto risultati migliori sui test fisici e della memoria. L'aumento dell'Nrf2 ha anche invertito le firme genetiche del MA nei topi modello, suggerendo che ha avuto un effetto normalizzante diffuso, oltre che affrontare semplicemente i grumi di tau e di Aβ.
“L'entità della riduzione di Aβ e tau e l'inversione quasi completa dei cambiamenti genetici è molto significativo”, dice Johnson, che ha contribuito a identificare il ruolo protettivo dell'Nrf2 via astrociti in altre malattie neurodegenerative prima di questo studio. “Oltre 2.300 geni cambiano in una parte del cervello in un modello di MA. E quasi tutti i 2.300 tornano alla normalità. Ero sbalordito. Non ho mai pensato che saremmo arrivati a quel risultato“.
L'Nrf2 controlla l'espressione di molti geni che proteggono da insulti come lo stress ossidativo o l'infiammazione. Si attiva nella fase avanzata del MA, ma la sua attivazione può avvenire troppo tardi per proteggere il cervello dalla malattia. Per studiare come l'attivazione persistente di Nrf2 negli astrociti potrebbe proteggere il cervello, il laboratorio di Johnson ha allevato topi che sovra-accumulavano Aβ intorno ai neuroni, per simulare il MA, e esprimevano molto Nrf2 negli astrociti.
Rispetto ai topi senza il potenziamento di Nrf2, quelli con molto gene avevano quasi il 90% in meno di Aβ nel cervello. Avevano anche molte meno placche di Aβ.
Un sintomo del MA, sia nei topi che negli esseri umani, è la perdita di memoria. I topi modello di MA con sovra-espressione di Nrf2 andavano molto meglio anche in un test classico della memoria, rispetto a quelli senza il gene potenziato, quasi come i topi non-MA. E, i topi con Nrf2 extra andavano molto meglio a navigare su un'asta simile a corda tesa, una misura di equilibrio e coordinazione.
Il collaboratore Giles Hardingham dell'Università di Edimburgo e il suo team hanno condotto esperimenti simili sui topi che avevano accumulato troppe proteine tau. Essi hanno scoperto che i topi con molta tau mantenevano circa il 25% in più di neuroni quando i loro astrociti avevano l'Nrf2 potenziato. Questi topi accumulavano anche meno proteine tau nei neuroni corticali del cervello.
“La sovra-espressione di Nrf2 ha avuto un impatto molto simile sia nei modelli di tau che di Aβ”, dice Hardingham. “In entrambi i casi, è molto chiaro che l'Nrf2 negli astrociti sta modulando la neuropatologia”.
Il team di ricerca sospetta che l'Nrf2 aumenti la capacità dei neuroni di digerire queste proteine come un modo per eliminarle. Rimane poco chiaro il modo esatto con cui il gene, che non è espresso nei neuroni ma negli astrociti di supporto vicini, realizza questa impresa. Inoltre, l'Nrf2 sembra fornire ulteriori benefici che non sono ancora ben compresi, come invertire in gran parte le mutazioni genetiche nel cervello associate alla malattia.
Anche se l'Nrf2 è un candidato interessante per i trattamenti anti-MA, in passato si è rivelato difficile attivarlo nel cervello con farmaci. Johnson dice che i trattamenti di nuova generazione, come i peptidi terapeutici e la terapia genica, possono essere un modo migliore per attivare il gene.
Un altro componente chiave per sviluppare trattamenti efficaci per il MA è diagnosticare i pazienti molto prima. I ricercatori hanno scoperto che il MA richiede molti anni, forse decenni, per svilupparsi pienamente. Trattare i pazienti prima che è possibile può migliorare i loro esiti.
“I nuovi strumenti diagnostici attualmente in fase di sviluppo saranno molto utili”, dice Johnson.
Fonte: Eric Hamilton in University of Wisconsin-Madison (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Zoeb Jiwaji, ... (+27), Jeffrey A. Johnson, Siddharthan Chandran, Giles Hardingham. Reactive astrocytes acquire neuroprotective as well as deleterious signatures in response to Tau and Aß pathology. Nature Communications, 10 Jan 2022, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.










 Associazione Alzheimer OdV
Associazione Alzheimer OdV