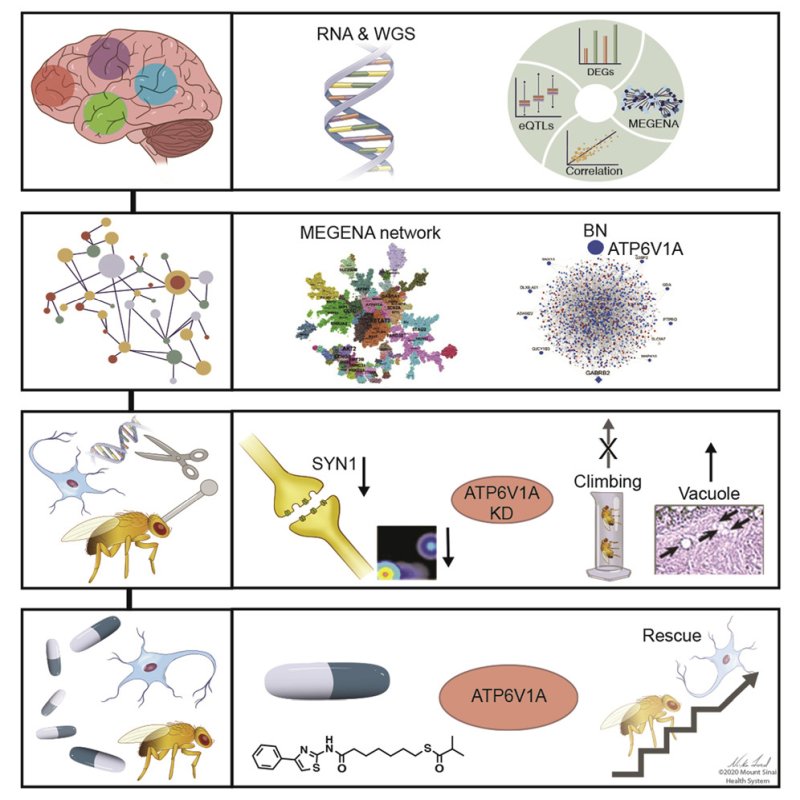
 Riassunto grafico della ricerca.
Riassunto grafico della ricerca.
Con uno studio pubblicato sulla rivista Neuron, ricercatori del Mount Sinai e del Centro Nazionale Geriatria e Gerontologia in Giappone hanno identificato nuovi meccanismi molecolari che guidano il morbo di Alzheimer ad esordio tardivo (MAET), nonché un promettente candidato terapeutico per il trattamento. Il MAET è la forma più diffusa di demenza tra le persone con più di 65 anni, un disturbo cerebrale progressivo e irreversibile che colpisce più di 5,5 milioni di persone negli Stati Uniti e la sesta causa di morte.
"Il nostro studio fa avanzare la comprensione della patogenesi del MAET rivelando non solo le sue strutture globali, ma anche i circuiti dettagliati di complesse interazioni e regolazioni molecolari nelle regioni cerebrali chiave colpite dal MAET", ha affermato l'autore senior Bin Zhang PhD, professore di genetica e scienze genomiche al Mt Sinai e direttore del Center for Transformative Disease Modeling. "I modelli di rete che abbiamo creato servono come modello per identificare nuovi bersagli terapeutici che rispondono direttamente all'urgente necessità di nuovi modi per prevenire, trattare e ritardare l'insorgenza del MAET".
Precedenti studi di associazione genetica sull'intero genoma (GWAS) hanno identificato alcune mutazioni genetiche associate al MAET, ma sono rimaste non caratterizzate le varianti causali della malattia. Per esplorare i meccanismi molecolari che guidano la patogenesi di MAET, il team guidato dal Mt Sinai ha eseguito un'analisi biologica di rete integrativa di un intero genoma e il sequenziamento dell'RNA di varie regioni cerebrali corticali su centinaia di donatori, sia sani che con MAET. Questo lavoro ha rivelato migliaia di cambiamenti molecolari e ha scoperto numerose sottoreti geniche specifiche di neuroni disregolate nel MAET.
Da quell'indagine i ricercatori hanno previsto che l'ATP6V1A, un gene che codifica proteine, ha un ruolo importante in un percorso di segnalazione cruciale del cervello e che il suo deficit potrebbe essere ricondotto al MAET. Tale collegamento è stato valutato usando due metodi: una tecnica basata su CRISPR per manipolare i livelli di ATP6V1A nelle cellule cerebrali in vitro abbinate a donatori e nell'abbattimento basato su RNAi in modelli di Drosophila transgenici, il che significa che il materiale genetico viene introdotto artificialmente nei moscerini della frutta e geni specifici sono realmente silenziati per studiare gli effetti. Infatti, l'abbattimento del ATP6V1A ha peggiorato la neurodegenerazione correlata al MAET in entrambi i modelli.
In modo altrettanto significativo, i ricercatori hanno predetto che un composto farmacologico, NCH-51, potrebbe normalizzare i geni disregolati nel MAET, incluso l'ATP6V1A, e hanno dimostrato che il NCH-51 ha migliorato notevolmente gli effetti neuronali e neurodegenerativi del deficit di ATP6V1A in entrambi i sistemi modello. In particolare, l'esperimento basato su CRISPR che ha usato cellule staminali pluripotenti indotte umane (hiPSC) ha dimostrato che la repressione di ATP6V1A, in particolare in combinazione con l'amiloide-β, un segno distintivo neuropatologico chiave dell'Alzheimer, ha avuto un impatto drastico sulla funzione neuronale.
"Il sistema basato sull'uomo che abbiamo creato si è rivelato un modo promettente per modellare i meccanismi alla base del rischio e della progressione di malattie come il MAET in cui non sono disponibili tessuti viventi", ha osservato Kristen Brennand PhD, professoressa associata di genetica e scienze genomiche al Mt Sinai e coautrice dello studio.
Anche gli esperimenti con le Drosophila sono stati rivelatori, dimostrando che il deficit di ATP6V1A ha esacerbato sia la tossicità mediata da amiloide-β che la degenerazione degli assoni mediata da tau.
"Questa scoperta suggerisce che l'ATP6V1A può avere ampi effetti neuroprotettivi e servire come potenziale bersaglio terapeutico per altre malattie neurodegenerative correlate alla tau", afferma il dott. Koichi Iijima, capo del dipartimento di ricerca di Alzheimer al National Center for Geriatrics and Gerontology in Giappone e coautore senior dello studio.
Come sottolinea il dottor Zhang, la ricerca rivoluzionaria del Mt Sinai e del suo partner giapponese potrebbe avere un significato oltre il semplice MAET. "Abbiamo creato una struttura per la modellazione avanzata di malattie umane complesse in generale", spiega, "e questo potrebbe portare alla scoperta di meccanismi molecolari e all'identificazione di nuovi bersagli in grado di fornire nuove terapie trasformative".
Fonte: Mount Sinai Health System (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Minghui Wang, ..., Valentina Fossati, Bin Zhang. Transformative Network Modeling of Multi-omics Data Reveals Detailed Circuits, Key Regulators, and Potential Therapeutics for Alzheimer’s Disease. Neuron, 24 Nov 2020, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.















 Associazione Alzheimer OdV
Associazione Alzheimer OdV