Un nuovo studio su Nature dimostra che, perché insorga la patologia tau, deve esserci l'attivazione dell'inflammasoma NLRP3, sia direttamente che a valle dell'amiloide-beta, nelle taupatie (come la demenza fronto-temporale) e nel morbo di Alzheimer (MA). I risultati dello studio suggeriscono inoltre che i pazienti con questi disturbi potrebbero beneficiare degli antagonisti dell'NLRP3.
L'annuncio proviene dalla IFM Therapeutics LLC di Boston, una società biofarmaceutica privata, focalizzata sullo sviluppo di terapie che modulano nuovi obiettivi del sistema immunitario innato per trattare patologie infiammatorie e cancro. Il team comprende Michael Heneka MD (Direttore del Dipartimento Malattie Neurodegenerative e di Gerontopsichiatria dell'ospedale della Università di Bonn e membro del consiglio consultivo clinico dell'IFM), Eicke Latz MD/PhD (dell'Università di Bonn, cofondatore di IFM) e James Stunden (scienziato dell'IFM).
Patologia tau, Alzheimer e taupatie
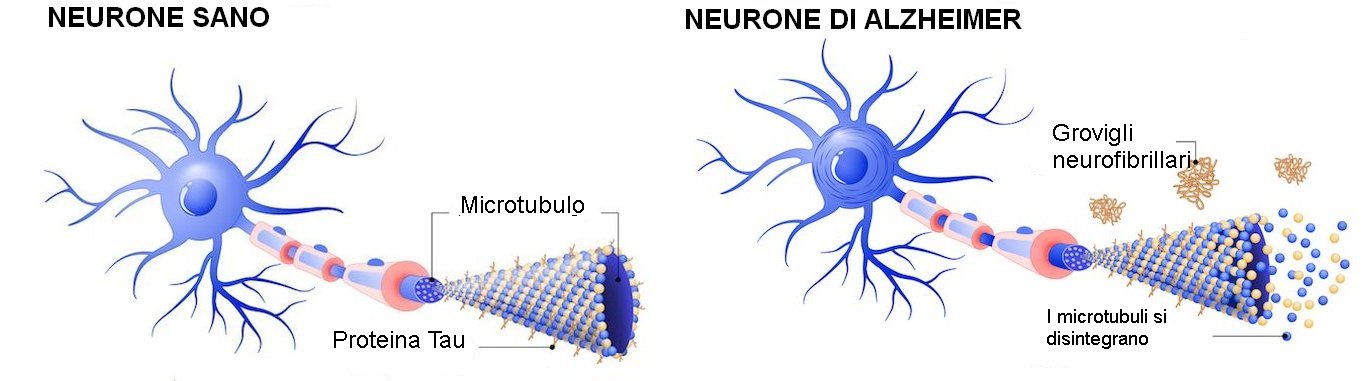
La proteina tau è cruciale per mantenere in salute il cervello, e serve a stabilizzare i microtubuli neuronali (vedi immagine in alto). Contrariamente alla tau dei neuroni normali, quella iperfosforilata e aggregata costituisce il nucleo dei grovigli neurofibrillari (NFT), una delle caratteristiche patologiche del MA.
Anche le taupatie primarie, come la demenza frontotemporale (FTD), presentano neuroinfiammazione e deficit cognitivi. Nello studio, i ricercatori hanno analizzato sia pazienti che modelli animali. Per identificare un ruolo potenziale dell'inflammasoma NLRP3 nei pazienti con taupatia, gli autori hanno analizzato campioni di corteccia di pazienti con FTD, trovando livelli ASC elevati e aumento di caspasi-1 attiva e di IL-1β maturo, che indicano l'attivazione dell'inflammasoma NLRP3.
In un modello di topo progettato per mimare le mutazioni FTD della tau umana, i topi hanno sviluppato patologia tau nel tempo, ed è stata anche rilevata la presenza di attivazione di NLRP3. Si è constatato inoltre che la tau ha attivato l'inflammasoma NLRP3 in maniera dipendente dall'NLRP3 stesso.
“I nostri risultati indicano che l'inflammasoma e le reazioni infiammatorie che innesca hanno un ruolo importante nella nascita della patologia tau”, ha detto Michael Heneka. “Questo studio fornisce una forte motivazione per influenzare la patologia tau mediante l'inibizione dell'inflammasoma NLRP3. Se la patologia tau potesse essere contenuta, sarebbe un passo importante verso una migliore terapia per coloro che vivono con le taupatie e il MA“.
L'inflammasoma lega amiloide-beta e tau
L'amiloide-beta (Aβ) è una proteina che si accumula tra i neuroni nel cervello, interrompe la comunicazione tra di loro e alla fine li uccide, costituendo così la causa primaria del MA. L'aggregazione delle proteine tau, che si accumulano all'interno dei neuroni, si verifica successivamente.
Ricerche precedenti condotte da Heneka e dal suo team hanno dimostrato che quando si deposita, l'Aβ provoca una risposta patologica immunitaria innata, e l'attivazione dell'inflammasoma NLRP3 è stata documentata nel cervello dei pazienti con MA. In questo studio, l'inflammasoma NLRP3 è considerato l'anello mancante nella catena di eventi che portano alla morte cellulare, poiché collega lo sviluppo della patologia Aβ con quello della patologia tau.
Martin Seidel, Vice Presidente esecutivo di Ricerca e Sviluppo della IFM, ha detto:
“Dimostrando che l'inflammasoma NLRP3 conduce direttamente al declino associato alla patologia tau nelle malattie neurodegenerative gravi, questo studio sottolinea il potenziale di puntare questo percorso. Dopo aver sviluppato il primo programma di antagonisti NLRP3 all'interno di 'IFM Tre' dall'inizio alla sperimentazione umana, un programma che è stato recentemente acquisito da Novartis, siamo particolarmente incoraggiati dal potenziale impatto per i pazienti con MA e altre taupatie.
"I risultati confermano ulteriormente l'approccio di sviluppo dei farmaci del nostro team, focalizzato su nuovi obiettivi del sistema immunitario innato. Ci auguriamo di poter continuare a guardare le ricerche che escono dai laboratori dei Dott. Heneka e Latz, mentre ci concentriamo sulla ulteriore progressione dei programmi interni di IFM, tra cui gli sforzi all'interno di 'IFM Due' rivolti al percorso cGAS-STING e agli altri nostri nuovi obiettivi entusiasmanti”.
Fonte: IFM Therapeutics, LLC. (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Christina Ising, Carmen Venegas, Shuangshuang Zhang, Hannah Scheiblich, Susanne Schmidt, Ana Vieira-Saecker, Stephanie Schwartz, Shadi Albasset, Róisín McManus, Dario Tejera, Angelika Griep, Francesco Santarelli, Frederic Brosseron, Sabine Opitz, James Stunden, Maximilian Merten, Rakez Kayed, Douglas Golenbock, David Blum, Eicke Latz, Luc Buée & Michael Heneka. NLRP3 inflammasome activation drives tau pathology. Nature, 20 Nov 2019, DOI
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.







 Associazione Alzheimer OdV
Associazione Alzheimer OdV