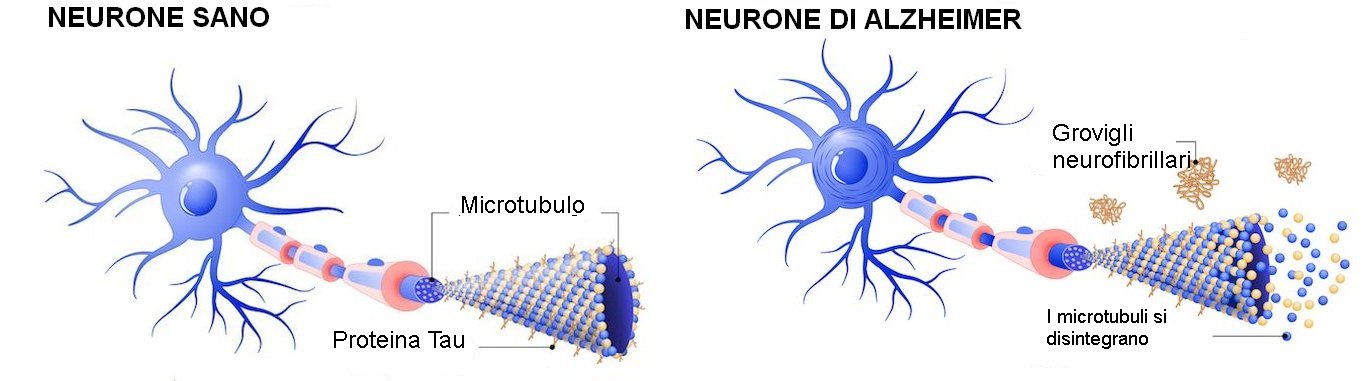
Ricercatori del Baylor College of Medicine, del Neurological Research Institute (Duncan NRI) al Texas Children’s Hospital e di altre istituzioni hanno scoperto che l'enzima TYK2 trasforma la proteina tau normale in una che si accumula nel cervello e contribuisce allo sviluppo del morbo di Alzheimer (MA) in animali modello [della malattia]. Lo studio, pubblicato su Nature Neuroscience, suggerisce che la contenzione parziale del TYK2 potrebbe essere una strategia per ridurre i livelli e la tossicità della tau.
"Molti studi hanno dimostrato che l'accumulo di tau nei neuroni e nelle cellule gliali nel cervello è una caratteristica importante del MA e di almeno altre 24 malattie neurologiche", ha affermato la prima autrice dott.ssa Ji-Yoen Kim, assistente prof.ssa di genetica molecolare e umana al Baylor, nel laboratorio della dott.ssa Huda Zoghbi, l'autrice senior del lavoro, prof.ssa e direttrice del Duncan NRI, nonché ricercatrice dell'Howard Hughes Medical Institute.
Studi precedenti avevano dimostrato che la tau è modificata chimicamente nella malattia, prevalentemente dall'aggiunta di fosfato ai gruppi di tirosina nella proteina e che questi cambiamenti hanno un ruolo cruciale nella regolazione dell'accumulo di tau. Il laboratorio della Zoghbi aveva già identificato il TYK2 - un enzima che aggiunge fosfato ai gruppi di tirosina - come potenziale regolatore dei livelli di tau e che abbattendo il gene TYK2 si riducono i livelli di tau nelle cellule umane.
Nel presente studio, il team ha scavato più a fondo nel modo in cui il TYK2 trasforma la tau in una proteina che si aggrega, si propaga alle cellule vicine e si accumula in grovigli all'interno delle cellule, influenzando lo sviluppo della neurodegenerazione guidata da tau. Lavorando con cellule umane e animali modello di demenza guidata da tau, i ricercatori sono i primi a dimostrare che le modifiche apportate dal TYK2 alla tau contribuiscono alla malattia mediata da tau.
"Abbiamo scoperto che il TYK2 aggiunge gruppi di fosfato alla tau in una posizione particolare sulla proteina, identificata come tirosina 29", ha detto la Kim. "Questa modifica stabilizza i livelli di tau nelle cellule umane e nei neuroni di topo rendendola resistente all'autofagia, un processo cellulare importante per eliminare le proteine. Essendo impermeabile alla sua eliminazione, la tau modificata si accumula nel cervello".
La scoperta che il TYK2 enfatizza l'aggregazione di tau ha suggerito che la manipolazione di TYK2 potrebbe aiutare a regolare l'aggregazione di tau e le sue conseguenze. Il team ha testato l'effetto di ridurre parzialmente il TYK2 in topi modello e ha scoperto che ciò era sufficiente per ridurre i livelli di tau e mitigare il suo accumulo.
"Sebbene sia necessario molto più lavoro, i nostri risultati suggeriscono che l'inibizione parziale di TYK2 potrebbe quindi essere una strategia per ridurre l'accumulo e la tossicità della tau", ha affermato Kim.
"Per questo obiettivo, siamo incoraggiati dal fatto che altri hanno sviluppato inibitori di TYK2 che sono stati testati nell'uomo per altre indicazioni", ha affermato la Zoghbi. "Sono necessari studi per vedere se questi inibitori entrano effettivamente nel cervello e abbassano i livelli di tau, per esplorare i loro potenziali effetti sul MA e sulla demenza indotta da tau".
Fonte: Graciela Gutierrez in Baylor College of Medicine (> English) - Traduzione di Franco Pellizzari.
Riferimenti: J Kim, [+8], HY Zoghbi. TYK2 regulates tau levels, phosphorylation and aggregation in a tauopathy mouse model. Nat Neurosci, 2024, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.











 Associazione Alzheimer OdV
Associazione Alzheimer OdV