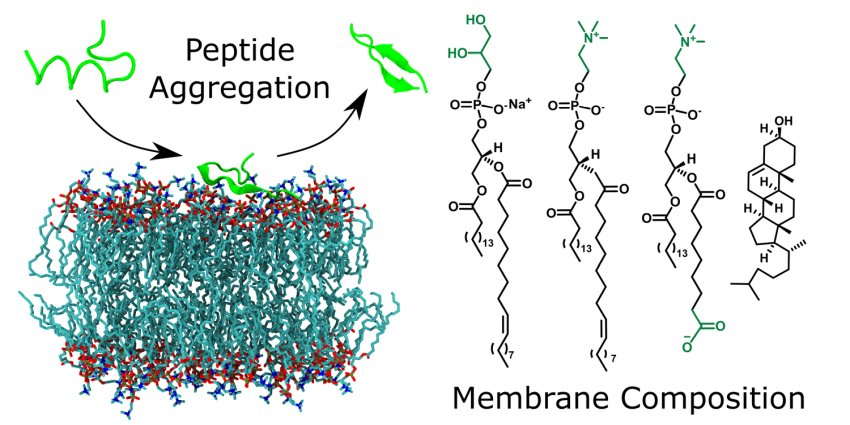
 I modelli di membrane ossidate hanno effetti diversi sulla formazione di fibrille peptidiche, guidati dall'attrazione della superficie della membrana, dalla carica peptidica e dalle proprietà strutturali peptidiche. Fonte: Università di Lipsia
I modelli di membrane ossidate hanno effetti diversi sulla formazione di fibrille peptidiche, guidati dall'attrazione della superficie della membrana, dalla carica peptidica e dalle proprietà strutturali peptidiche. Fonte: Università di Lipsia
Nonostante i notevoli progressi nella ricerca, non esiste ancora alcuna cura per molte malattie legate all'età, come il morbo di Alzheimer (MA). Un'ipotesi per questa malattia è l'aggregazione di peptidi nel cervello, ma si sospetta che anche lo stress sia un possibile innesco.
Scienziati dell'Università di Lipsia e del Leibniz Institute of Surface Engineering (Germania), della Monash University (Australia), e dell'Università di Göttingen (Svezia) hanno studiato i legami tra membrane cellulari ossidate e aggregazione peptidica e ora hanno pubblicato i loro risultati su Chemical Science.
I ricercatori volevano capire meglio come le membrane cellulari nel corpo influenzano la struttura dei peptidi (molecole costituite da aminoacidi) e la loro aggregazione. Per fare ciò, hanno usato sistemi modello che sono facili da controllare sperimentalmente.
Il primo autore dott. Torsten John, che ha ottenuto il dottorato sotto la supervisione del prof. Bernd Abel a Lipsia, ed è ora ricercatore al Massachusetts Institute of Technology (MIT) negli Stati Uniti, spiega:
“Uno degli effetti dello stress nel corpo è che determina processi ossidativi e quindi cambia la composizione chimica delle membrane. Nei nostri esperimenti, abbiamo confrontato gli effetti delle membrane ossidate con quelle che non erano cambiate".
Gli scienziati hanno combinato sia esperimenti di laboratorio biofisico che simulazioni al computer per comprendere meglio l'aggregazione dei peptidi.
"Le simulazioni di computer, note come simulazioni di dinamica molecolare, forniscono informazioni molecolari sui meccanismi di interazioni tra membrane e peptidi", spiega il prof. Abel.
Si sapeva già che la composizione della membrana ha un ruolo importante nell'aggregazione dei peptidi, tuttavia ci sono state poche ricerche sul ruolo delle membrane ossidate. I ricercatori hanno scoperto che gli effetti differiscono tra i vari peptidi.
Uno dei peptidi studiati (Aβ40), che è associato al MA, si aggrega più velocemente in presenza di tutte le membrane. Al contrario, non c'è stata aggregazione di un altro peptide (uperin 3.5) in presenza della stessa quantità di membrane ossidate. Il professor Abel spiega:
"A seconda delle proprietà del peptide, compresa la sua carica, cambia la sua attrazione alla membrana e quindi la forza dell'influenza. Se i peptidi si accumulano sulla superficie della membrana, ciò accelera il loro assemblaggio e aggregazione. Tuttavia, se l'attrazione è molto forte e cambiano la loro struttura in un'elica, allora non possono più aggregarsi".
Gli scienziati per il loro studio hanno deliberatamente scelto peptidi che si aggregano in modo simile, ma con origine diversa. L'Aβ40 è noto per depositarsi nel cervello delle persone con MA, mentre l'uperin 3.5 è un peptide antimicrobico scoperto per la prima volta in una specie di rospo australiano.
In precedenza, il team di ricercatori guidato dalla prof.ssa Lisandra L. Martin della Monash University aveva riferito di possibili legami tra aggregazione di peptidi nelle malattie neurodegenerative e le proprietà antimicrobiche dei peptidi. Lo studio ("Polymers under Multiple Constraints: Restricted and Controlled Molecular Order and Mobility"), pubblicato sulla rivista Chemical Science, discute ulteriormente il ruolo funzionale dei peptidi amiloidi.
Fonte: Universität Leipzig (> English) - Traduzione di Franco Pellizzari.
Riferimenti: J Torsten, ...[+4], ML Lisandra. Lipid oxidation controls peptide self-assembly near membranes through a surface attraction mechanism. Chemical Science, 2 Mar 2023, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.










 Associazione Alzheimer OdV
Associazione Alzheimer OdV