Scienziati di Scripps Research e del MIT hanno scoperto che una proteina immunitaria modificata, che danneggia le connessioni cerebrali, è molto più comune nel cervello delle donne con Alzheimer, rispetto agli uomini.
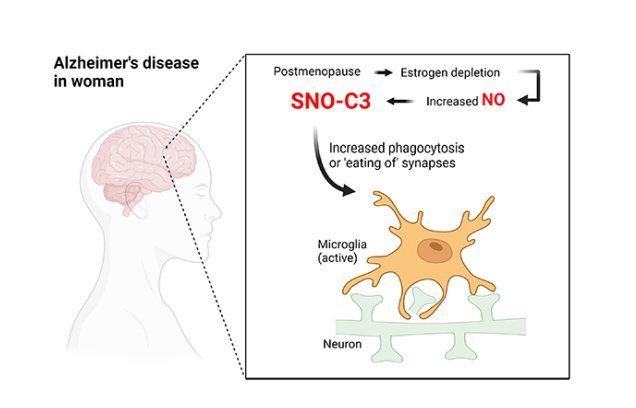 Nelle donne postmenopausa, l'esaurimento degli estrogeni provoca un eccessivo aumento dell'ossido nitrico (NO) nel cervello e quindi genera il fattore di complemento S-nitrosilato C3 (SNO-C3), che induce le microglia a fagocitare le sinapsi. Fonte: Chang-Ki OH e Stuart Lipton
Nelle donne postmenopausa, l'esaurimento degli estrogeni provoca un eccessivo aumento dell'ossido nitrico (NO) nel cervello e quindi genera il fattore di complemento S-nitrosilato C3 (SNO-C3), che induce le microglia a fagocitare le sinapsi. Fonte: Chang-Ki OH e Stuart Lipton
Scienziati di Scripps Research e del Massachusetts Institute of Technology (MIT) hanno trovato un indizio sulla causa molecolare del morbo di Alzheimer (MA), un indizio che può spiegare anche perché le donne hanno un rischio maggiore di questa malattia.
Nello studio, riportato il 14 dicembre 2022 su Science Advances, i ricercatori hanno scoperto che una forma immunitaria infiammatoria particolarmente dannosa e chimicamente modificata, era presente a livelli molto più alti nel cervello delle donne che erano morte con la malattia, rispetto agli uomini morti per lo stesso motivo. Hanno anche dimostrato che gli estrogeni - la cui produzione cade nella menopausa - proteggono di norma dalla creazione di questa forma del complemento C3.
"I nostri nuovi risultati suggeriscono che la modifica chimica di una componente del sistema di complemento aiuta a guidare il MA e può spiegare, almeno in parte, perché la malattia colpisce prevalentemente le donne", afferma l'autore senior Stuart Lipton MD/PhD, professore e docente del Dipartimento di Medicina Molecolare di Scripps Research e neurologo clinico a La Jolla, in California.
Lo studio è stato una collaborazione con un team guidato da Steven Tannenbaum PhD, professore di ingegneria biologica, di chimica e di tossicologia del MIT.
Il MA, la forma più comune di demenza che arriva con l'invecchiamento, attualmente affligge circa 6 milioni di persone solo negli Stati Uniti. È sempre fatale, di solito entro un decennio dall'insorgenza, e non esiste un trattamento approvato che possa fermare il processo della malattia, per non parlare di invertirlo. Le carenze dei trattamenti riflettono il fatto che gli scienziati non hanno mai capito appieno come si sviluppa la malattia; non sappiamo nemmeno del tutto perché le donne rappresentano quasi i due terzi dei casi.
Il laboratorio di Lipton studia gli eventi biochimici e molecolari che possono essere alla base delle malattie neurodegenerative, inclusa la reazione chimica che costituisce un tipo modificato di complemento C3, un processo chiamato S-nitrosilazione proteico. Lipton e i suoi colleghi avevano scoperto in precedenza questa reazione chimica, che si verifica quando una molecola correlata all'ossido nitrico (NO) si lega strettamente ad un atomo di zolfo (S) su un particolare blocco di aminoacidi di costruzione delle proteine, per formare una 'proteina-SNO' modificata.
Le modifiche delle proteine da parte di piccoli gruppi di atomi come i NO sono comuni nelle cellule e in genere attivano o disattivano le funzioni di una proteina bersaglio. Per motivi tecnici, la S-nitrosilazione è stata più difficile da studiare rispetto ad altre modifiche proteiche, ma Lipton sospetta che le 'tempeste di SNO' di queste proteine potrebbero contribuire crucialmente al MA e ad altri disturbi neurodegenerativi.
Per il nuovo studio, i ricercatori hanno usato nuovi metodi per rilevare la S-nitrosilazione e quantificare le proteine modificate in 40 cervelli umani post mortem. La metà dei cervelli proveniva da persone che erano morte di MA e metà proveniva da persone che non lo avevano, e ogni gruppo era diviso equamente tra maschi e femmine.
In questi cervelli, gli scienziati hanno trovato 1.449 proteine diverse che erano state S-nitrosilate. Tra le proteine modificate più spesso in questo modo, ce n'erano diverse che sono già state legate al MA, incluso il complemento C3. Sorprendentemente, i livelli di C3 S-nitrosilato (SNO-C3) erano oltre 6 volte più alti nel cervello delle femmine con MA, rispetto a quello dei maschi con MA.
Il sistema del complemento è una parte evolutivamente più antica del sistema immunitario umano. È costituito da una famiglia di proteine, che comprende la C3, che può attivarsi l'una con l'altra per guidare l'infiammazione in quella che viene chiamata 'cascata del complemento'. Gli scienziati sanno da più di 30 anni che il cervello di MA ha livelli più elevati di proteine del complemento e altri marcatori di infiammazione, rispetto al cervello neurologicamente normale.
Ricerche più recenti hanno dimostrato specificamente che le proteine del complemento possono indurre le cellule immunitarie del cervello chiamate microglia a distruggere le sinapsi, i punti di connessione attraverso i quali i neuroni si inviano segnali l'uno con l'altro. Molti ricercatori ora sospettano che questo meccanismo di distruzione delle sinapsi sia almeno in parte alla base del processo di malattia del MA e la perdita di sinapsi si è dimostrata correlata significativamente con il declino cognitivo nel cervello di MA.
Perché l'SNO-C3 sarebbe più comune nel cervello femminile con MA? C'è da tempo l'evidenza che l'ormone femminile può avere effetti protettivi cerebrali in alcune condizioni; pertanto, i ricercatori hanno ipotizzato che gli estrogeni proteggano specificamente il cervello delle donne dalla S-nitrosilazione C3, e questa protezione si perde quando i livelli di estrogeni cadono bruscamente con la menopausa.
Esperimenti con cellule cerebrali umane in coltura hanno confermato questa ipotesi, rivelando che l'SNO-C3 aumenta quando i livelli di estrogeni (β-estradiolo) diminuiscono, a causa dell'attivazione di un enzima che produce NO nelle cellule cerebrali. Questo aumento dell'SNO-C3 attiva la distruzione microgliale delle sinapsi.
"Perché le donne hanno maggiori probabilità di avere il MA è da tempo un mistero, ma penso che i nostri risultati rappresentino un pezzo importante del puzzle che spiega meccanicisticamente la maggiore vulnerabilità delle donne mentre invecchiano", afferma Lipton.
Lui e i suoi colleghi ora sperano di condurre ulteriori esperimenti con composti de-nitrosilanti, che rimuovono la modifica SNO, per vedere se possono ridurre la patologia nei modelli animali di MA e poi nell'uomo.
Fonte: Scripps Research Institute (> English) - Traduzione di Franco Pellizzari.
Riferimenti: H Yang, ...[+7], SR Tannenbaum, SA Lipton. Mechanistic insight into female predominance in Alzheimer’s disease based on aberrant protein S-nitrosylation of C3. Science Advances, 2022, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.









 Associazione Alzheimer OdV
Associazione Alzheimer OdV