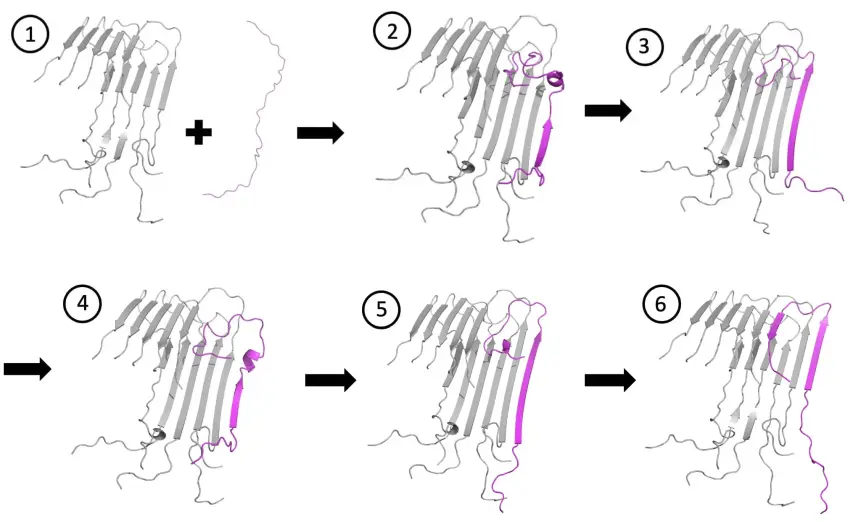
 Sequenza dei modelli computazionali mostra come un peptide amiloide-beta (magenta) si aggancia e si blocca a una fibrilla amiloide. Le simulazioni hanno rivelato che nelle conformazioni intermedie nei passaggi da 2 a 5, è presente una frustrazione nell'associazione che può dare nuove opportunità di trattamento. (Fonte: Kaitlin Knapp / Rice University)
Sequenza dei modelli computazionali mostra come un peptide amiloide-beta (magenta) si aggancia e si blocca a una fibrilla amiloide. Le simulazioni hanno rivelato che nelle conformazioni intermedie nei passaggi da 2 a 5, è presente una frustrazione nell'associazione che può dare nuove opportunità di trattamento. (Fonte: Kaitlin Knapp / Rice University)
I progressi per un trattamento del morbo di Alzheimer (MA) sono stati frustantemente lenti. Un gruppo di scienziati di Houston suggerisce che la frustrazione a una scala molto ridotta può portare a un nuovo percorso di trattamento.
I ricercatori dell'Università di Houston (UH) e della Rice University, associati al Center for Theoretical Biological Physics (CTBP) della Rice, hanno scoperto attraverso esperimenti e calcoli che i peptidi amiloide-beta (Aβ), piccole molecole che sono abbondanti nel cervello, passano attraverso diverse fasi intermedie di frustrazione mentre 'si agganciano e si bloccano' sulle punte delle fibrille in crescita.
Le proteine in piegatura tendono a cercare il modo più semplice per arrivare alla loro forme funzionale. Allo stesso modo, i peptidi Aβ cercano il modo più semplice per legare le punte delle fibrille in crescita, ma a volte sono tenuti indietro (frustrati) quando le forze positive e negative tra gli atomi non si allineano immediatamente.
Quando finalmente si allineano, le fibrille in crescita formano le placche gommose implicate nel MA e in altre malattie neurologiche. Una nuova ricerca pubblicata su PNAS mostra che si potrebbero sviluppare farmaci per sfruttare gli stadi intermedi frustrati dei peptidi, per stabilizzare le punte della fibrilla e bloccarne l'ulteriore aggregazione.
Peter Vekilov, ingegnere chimico e biomolecolare della UH, ha detto che non era stata una forzatura esaminare la crescita della fibrilla Aβ nel suo laboratorio:
"Studi precedenti, che hanno osservato le proteine fibrilizzanti con un microscopio a forza atomica, si erano focalizzati su comportamenti più esotici perché le fibrille Aβ con un tasso costante di crescita sono noiose da osservare.
"Ma ero affascinato perché la correlazione del tasso di crescita alla concentrazione di peptidi nella soluzione porta molte informazioni. È di aiuto misurare la costante del tasso, una quantità che è facile da modellare".
Ha detto che Peter Wolynes, fisico della Rice, il cui laboratorio è specializzato nel costruire modelli computerizzati di proteine e di piegatura di cromosomi, ha suggerito che interrompendo la crescita costante con urea, nota per impoverire (o dispiegare) le proteine, si potrebbero ottenere dati utili su come si formano le fibrille Aβ. Lo ha fatto sicuramente secondo Vekilov:
"È successa una cosa strana. L'urea ha reso le fibrille meno stabili, il che significava che i legami tra le molecole nelle fibrille erano meno forti. Ma le ha anche fatte crescere più velocemente.
"Questa è una grave contraddizione, una violazione delle regole empiriche della chimica. Ma ci sono regole empiriche, e poi ci sono leggi fondamentali. Abbiamo pensato che questo sta cercando di dirci qualcosa".
"Ulteriori esperimenti hanno dimostrato che l'urea destabilizzava i legami sbagliati del peptide. Ha fatto crescere la fibrilla più velocemente, ma ci ha mostrato anche i passaggi intermedi frustrati. La cosa importante è che ora abbiamo prove che alla fine della fibrilla c'è una corona di catene peptidiche frustrate e disordinate che cercano di agganciarsi e bloccarsi, e questi sono obiettivi per farmaci.
"È irrazionale bloccare ogni singolo peptide, perché probabilmente ce ne sono 100.000 volte di più delle punte di fibrilla. La bellezza di ciò che abbiamo trovato è che la punta della fibrilla è un tallone di Achille della fibrilizzazione, e tutto ciò che dobbiamo fare è bloccare il complesso alla punta".
Wolynes ha notato che c'erano segni di frustrazione in uno studio precedente che aveva visto evidenze di intralci nell'aggregazione della fibrilla:
"Due cose sono emerse dagli esperimenti. Una è che quasi tutti i modelli cinetici usati dai ricercatori per la crescita dell'Aβ sono troppo semplici. Questo non è inaspettato. L'altra è che l'impoverimento cambia l'equilibrio e può anche modificare il tasso di piegatura in modi che ti dicono dove appaiono gli stadi delle transizioni.
"Nella ricerca precedente sulla nucleazione della fibrilla, abbiamo osservato che sembrava ci fossero alcuni strani processi in cui le proteine dovevano tornare indietro dallo stato di transizione. Così Peter ha studiato questo, e penso che sia la prima persona a farlo".
"Avere un modo per impedire alle fibrille di crescere può aiutare a risolvere un disaccordo di lunga data tra gli scienziati sul fatto che le fibrille causino malattie neurologiche o proteggano il cervello da un altro sospetto, in particolare le proteine tau aggrovigliate.
"La nostra idea è di avvelenare la punta in modo che non possa crescere, piuttosto che destabilizzare l'intera fibrilla. Questo, ovviamente, entra nel grande dibattito se le fibrille sono buone o cattive".
I modelli computazionali potrebbero mostrare che l'arresto delle fibrille potrebbe arginare gli effetti del MA o peggiorarlo. Indipendentemente, Wolynes ha detto che gli scienziati avranno una risposta più definitiva:
"A mio parere, ciò che è interessante qui è fornire un nuovo obiettivo, e esploreremo alcuni possibili farmaci che potrebbero cambiare la natura della punta. In ogni caso, quelle molecole forniranno strumenti interessanti per capire come avviene la crescita della fibrilla".
Fonte: Mike Williams in Rice University (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Yuechuan Xu, Kaitlin Knapp, Kyle Le, Nicholas Schafer, Mohammad Safari, Aram Davtyan, Peter Wolynes, Peter Vekilov. Frustrated peptide chains at the fibril tip control the kinetics of growth of amyloid-β fibrils. PNAS, 2021, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.














 Associazione Alzheimer OdV
Associazione Alzheimer OdV