Scienziati dell'Università della Columbia Britannica hanno individuato un paio di passi cruciali nella formazione della proteina amiloide-beta, che si accumula in grumi, o "placche", nel cervello delle persone con Alzheimer. Queste scoperte hanno ispirato gli sforzi per impedire il taglio biochimico della proteina precursore dell'amiloide-beta nella sua forma finale tossica.
Gli ultimi farmaci sperimentati tentano di silenziare un enzima, chiamato BACE1, che taglia la proteina precursore. Ma il BACE1 ha altre funzioni che sono vantaggiose, perciò il suo blocco totale potrebbe portare effetti collaterali indesiderati, tra cui il disturbo della produzione di mielina, l'isolamento protettivo delle cellule cerebrali.
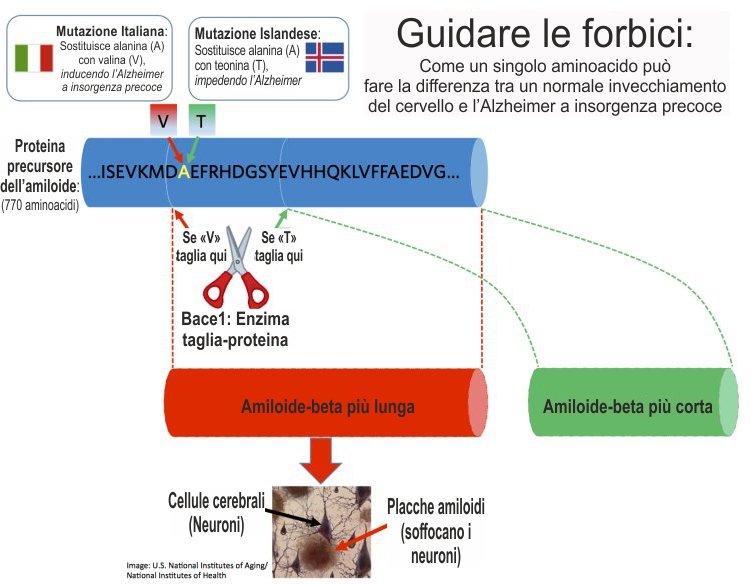
Weihong Song, professore di psichiatria e ricercatore di Alzheimer, ha scoperto che un cambio del punto dove viene fatto il taglio - in effetti, guidare le forbici dell'enzima ad un altro punto - potrebbe raggiungere lo stesso obiettivo, con meno danni collaterali.
Il dottor Song ha usato le scoperte di due rare mutazioni nell'ultimo decennio: una, trovata negli italiani, che porta all'Alzheimer, e un'altra, trovata negli islandesi, che ritarda l'Alzheimer. Il team del dottor Song dei Townsend Family Laboratories della UBC si è particolarmente interessato agli effetti diametralmente opposti delle due mutazioni, perché interessano lo stesso punto sulla catena di 770 aminoacidi della proteina precursore, scambiando un acido con un altro.
Come scritto dal Dr. Song e il suo team nel numero del 19 luglio del Journal of Neuroscience, essi hanno iniettato in una serie di topi un virus che trasporta la mutazione del gene italiano e a un altro gruppo la mutazione islandese.
Hanno scoperto che la sostituzione dell'amminoacido influenza il punto dove è tagliata la proteina precursore. La mutazione islandese provoca una forma abbreviata di amiloide-beta, che non diventa "appiccicosa" e non si trasforma in placca. La mutazione italiana ha prodotto una versione più lunga, più "appiccicosa", di amiloide-beta, che diventa in ultima analisi la placca che soffoca il neurone.
In realtà gli effetti erano una questione di grado: ogni mutazione portava a più tagli in una posizione o più tagli nell'altra posizione. Ma nel degrado graduale dell'Alzheimer, ciò potrebbe essere sufficiente: ridurre i livelli della tossina dannosa potrebbe tradursi in molti altri anni di vita prima che insorga il declino cognitivo.
"Se riusciamo a regolare il punto dove il BACE1 taglia la proteina precursore, avremo un modo molto preciso di rallentare l'accumulo di placca nel cervello, senza influenzare altri processi", spiega il dottor Song, docente di ricerca di Alzheimer e professore. "Questo fornisce un nuovo bersaglio nella ricerca di un farmaco che assomiglia di più a un bisturi che a una mazza".
Fonte: University of British Columbia (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Shuting Zhang, Zhe Wang, Fang Cai, Mingming Zhang, Yili Wu, Jing Zhang and Weihong Song. BACE1 cleavage site selection critical for amyloidogenesis and Alzheimer's pathogenesis. Journal of Neuroscience 16 June 2017, 0340-17; DOI: 10.1523/JNEUROSCI.0340-17.2017
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.















 Associazione Alzheimer OdV
Associazione Alzheimer OdV