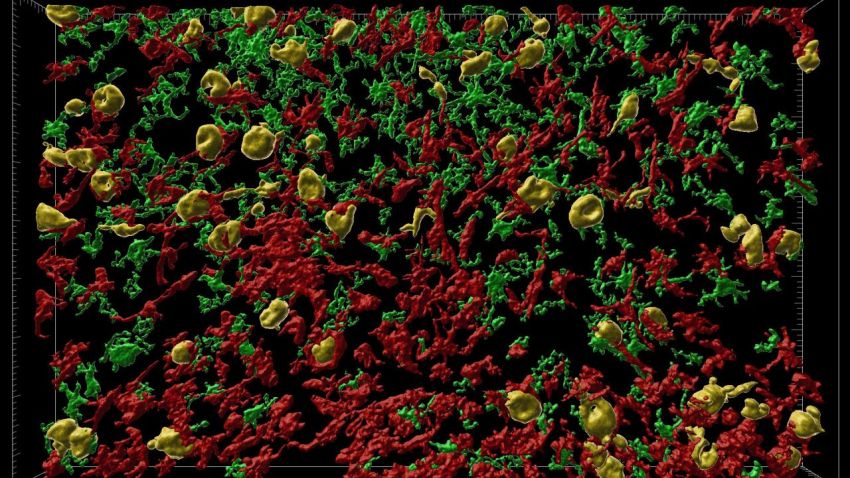
 Ricostruzione della neuroinfiammazione in 3D.
Ricostruzione della neuroinfiammazione in 3D.
La nostra conoscenza del morbo di Alzheimer (MA) è cresciuta rapidamente negli ultimi decenni, ma si è dimostrato difficile tradurre le scoperte fondamentali sulla malattia in nuovi trattamenti. Ora dei ricercatori del California National Primate Research Center dell'Università della California di Davis, hanno sviluppato un modello delle prime fasi del MA con macachi rhesus.
Il macaco modello, come da studio pubblicato il 18 marzo su Alzheimer's & Dementia: il Journal of the Alzheimer's Association potrebbe consentire di testare meglio nuovi trattamenti. Il modello è stato sviluppato dal laboratorio del prof. John Morrison al CNPRC, in collaborazione con il prof. Jeffrey Krodower della Rush University e Paramita Chakrabarty, assistente prof.ssa dell'Università della Florida.
Si ritiene che il MA sia causato da una errata piegatura delle proteine tau e amiloide, che si diffondono nel cervello, portando all'infiammazione e alla morte cellulare. La proteina tau si trova comunemente nei neuroni del cervello e del sistema nervoso centrale, ma non altrove. I ricercatori pensano che passino decenni tra l'inizio silenzioso della malattia e i primi segni di declino cognitivo. Capire cosa succede in questi anni potrebbe essere la chiave per prevenire o invertire i sintomi del MA.
Ma è difficile delineare strategie terapeutiche senza un potente modello animale che assomiglia molto alla condizione umana, ha detto Morrison. Molte ricerche si sono concentrate sui topi transgenici che esprimono una versione umana delle proteine amiloide o tau, ma questi studi si sono dimostrati difficili da tradurre in nuovi trattamenti.
Servono nuovi modelli traslazionali
"Gli esseri umani e le scimmie hanno due forme della proteina tau nel cervello, ma i roditori ne hanno solo una", ha detto Danielle Beckman, ricercatrice post-dottorato del CNPRC e prima autrice dello studio. "Pensiamo che il macaco sia un modello migliore, perché esprime nel cervello le stesse versioni di tau degli umani".
I topi mancano anche di alcune aree della neocorteccia, come quella prefrontale, una regione del cervello umano che è molto vulnerabile al MA. La corteccia prefrontale è presente nei macachi rhesus ed è criticamente importante per le funzioni cognitive degli umani e delle scimmie. C'è assoluto bisogno di modelli animali nuovi e migliori per il MA, che dovrebbero stare tra i topi modello e le sperimentazioni cliniche umane, ha detto la Beckman.
La Chakrabarty e i suoi colleghi hanno creato versioni del gene umano tau con mutazioni che causano l'errato ripiegamento, avvolte in una particella di virus. Questi vettori sono stati iniettati in macachi rhesus, in una regione del cervello chiamata corteccia entorinale, che è molto vulnerabile al MA.
Entro tre mesi, hanno visto che le proteine tau mal ripiegate si erano diffuse in altre parti del cervello dell'animale. Hanno scoperto un ripiegamento errato sia nelle proteine tau mutanti umane introdotte che nelle proteine tau proprie della scimmia.
"Il modello di diffusione ha dimostrato inequivocabilmente che la patologia tau ha seguito le connessioni precise della corteccia entorinale e che la semina della tau patologica è passata da una regione alla successiva attraverso le connessioni sinaptiche", ha detto Morrison. "Questa capacità di diffondersi attraverso i circuiti cerebrali provoca il danno alle aree corticali responsabili della cognizione di livello superiore piuttosto distanti dalla corteccia entorinale".
La stessa squadra in precedenza aveva realizzato nei macachi la diffusione di proteine amiloidi mal ripiegate, una delle prime fasi del MA, iniettando brevi pezzi di amiloide difettosa. Il nuovo modello di proteina tau probabilmente rappresenta una fase intermedia della malattia, ha detto la Beckman: "Pensiamo che questo rappresenti una fase più degenerativa, ma prima che si verifichi la morte cellulare diffusa".
I ricercatori hanno pianificato di verificare se i cambiamenti comportamentali paragonabili al MA umano si sviluppano nel modello di macaco rhesus. In tal caso, potrebbe essere usato per testare terapie che impediscono il ripiegamento errato o l'infiammazione.
"Stiamo lavorando da 4 anni per sviluppare questi modelli", ha detto Morrison. "Non penso che si possa fare senza una grande squadra collaborativa e le ampie risorse di un centro nazionale di ricerca sui primati".
Fonte: Andy Fell in University of California - Davis (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Danielle Beckman, Paramita Chakrabarty, Sean Ott, Amanda Dao, Eric Zhou, William Janssen, Kristine Donis‐Cox, Scott Muller, Jeffrey Kordower, John Morrison. A novel tau‐based rhesus monkey model of Alzheimer's pathogenesis. Alzheimer's & Dementia, 2021, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.









 Associazione Alzheimer OdV
Associazione Alzheimer OdV