Esplorando le modifiche post-traslazionali di una proteina chiave del Parkinson, ricercatori di EPFL e USC hanno scoperto potenziali percorsi per terapie future nelle malattie neurodegenerative in generale.
 Schema grafico dei risultati della ricerca.
Schema grafico dei risultati della ricerca.
Le malattie neurodegenerative, come l'Alzheimer e il Parkinson, presentano una sfida sanitaria significativa, colpendo oltre 50 milioni di persone a livello globale. Una caratteristica comune di queste malattie è l'accumulo di aggregati proteici mal ripiegati nel cervello, chiamati 'fibrille amiloidi', che interrompono la funzione normale delle cellule e alla fine ne causano la morte.
In un nuovo studio, scienziati guidati da Hilal Lashuel dell'EPFL e Matthew R. Pratt della University of Southern California hanno fatto un progresso significativo per capire come le modifiche post-traslazionali (cambiamenti che si verificano nelle proteine dopo che sono sintetizzate nella cellula) possono influenzare la formazione e la patogenicità di queste fibrille amiloidi.
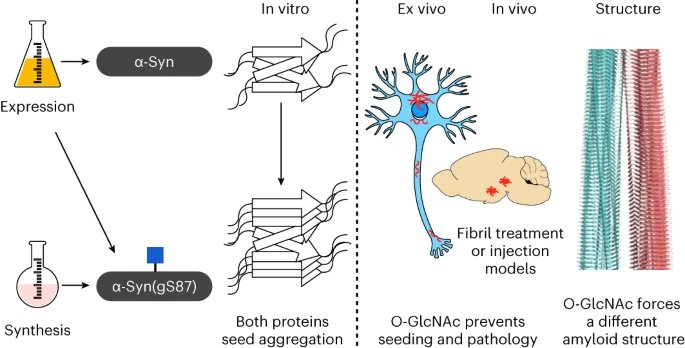
I ricercatori hanno studiato la proteina alfa-sinucleina, che è legata alla formazione di fibrille amiloidi nel Parkinson, in particolare una modifica specifica che subisce la proteina, tecnicamente chiamata 'O-linked β-N-acetylglucosamine' (O-GlcNAc).
La O-GlcNAc è una sorta di modifica che aggiunge una singola molecola di zucchero a residui specifici di serina o treonina nella proteina, alterando così la sua funzione e le sue proprietà. È collegata a numerosi processi biologici, che comprendono l'aggregazione proteica e la neurodegenerazione. Questa modifica, in particolare sull'alfa-sinucleina, ha dimostrato di rallentare l'aggregazione amiloide e proteggere potenzialmente i neuroni.
Precedenti studi dei gruppi di Pratt e Lashuel avevano suggerito che aumentare la modifica di O-GlcNAc potrebbe avere un potenziale terapeutico nelle prime fasi della malattia neurodegenerativa, alterando le proprietà degli aggregati proteici per prevenire la loro semina e diffusione nel cervello, rallentando potenzialmente la progressione della malattia.
Basandosi su questo, il team ha impiegato metodi chimici innovativi per produrre fibrille alfa-sinucleine modificate, lavorando con il gruppo di Virginia Lee all'Università della Pennsylvania. Hanno anche usato modelli cellulari e animali per studiare come l'O-GlcNAc influisce sulle proprietà patogene dell'alfa-sinucleina e hanno lavorato con il gruppo di Lorena Saelices del Centro medico dell'UT Southwestern per osservare le fibrille modificate con la microscopia crioelettronica.
Lo studio ha dimostrato che aumentare la modifica genera fibrille con caratteristiche strutturali e biochimiche distinte. Queste fibrille producono un ceppo di fibrilla amiloide con una capacità drasticamente ridotta di seminare l'aggregazione nei neuroni e nei modelli animali di Parkinson. È interessante notare che questo ceppo di fibrille può seminare l'aggregazione in vitro, ma non nei neuroni o nei topi vivi.
"I nostri risultati mostrano che questo ambiente nella cellula ha un ruolo importante nel determinare la patogenicità di questa proteina", afferma Anne-Laure Mahul-Melier, prima coautrice dello studio.
Lo studio suggerisce che modifiche come O-GlcNAc potrebbero avere un ruolo nel modulare la patogenicità dell'alfa-sinucleina, aprendo nuove strade per la ricerca di potenziali trattamenti. Ad esempio, puntare il processo di modifica di O-GlcNAc potrebbe portare a terapie che alterano la progressione del Parkinson influenzando la capacità delle specie patogene di alfa-sinucleina di diffondersi in diverse regioni cerebrali.
In una esposizione breve di ricerche organizzata da Nature, gli autori scrivono: “Il nostro lavoro sulla modifica O-GlcNAc dell'alfa-sinucleina fa nuova luce sui determinanti molecolari della patobiologia delle fibrille amiloidi e fornisce nuovi obiettivi terapeutici per prevenire crescita e diffusione dell'amiloide nelle fasi iniziali e tardive dello sviluppo e della progressione della malattia".
Fonte: Nik Papageorgiou in Ecole Polytechnique Fédérale de Lausanne (> English) - Traduzione di Franco Pellizzari.
Riferimenti: AT Balana, [+13], HA Lashuel, Matthew R. Pratt. O-GlcNAc forces an α-synuclein amyloid strain with notably diminished seeding and pathology. Nature Chemical Biology, 2024, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.











 Associazione Alzheimer OdV
Associazione Alzheimer OdV