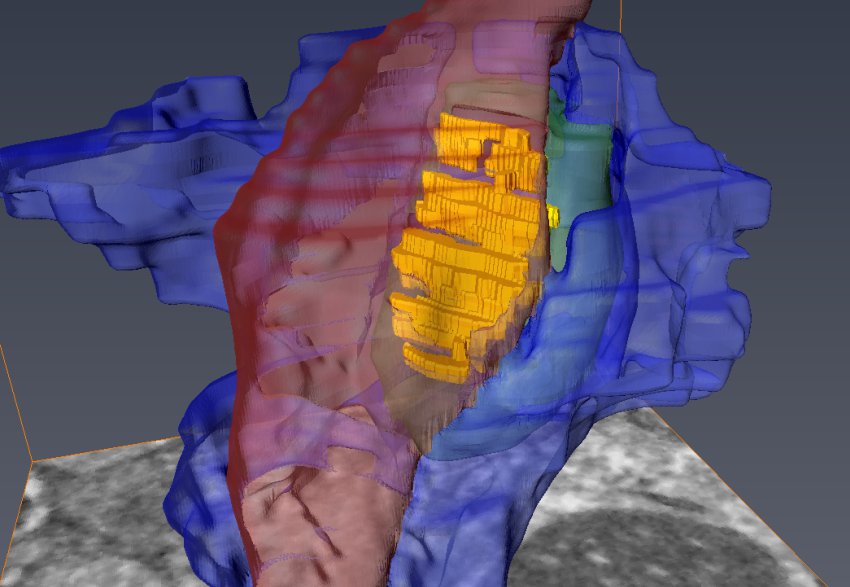
 Modello 3D in trasparenza che mostra l'assone (rosso), il motoneurone spinale medio (verde) e l'astrocita (blu) che convergono nella sinapsi (giallo). Fonte: Villanueva et al.
Modello 3D in trasparenza che mostra l'assone (rosso), il motoneurone spinale medio (verde) e l'astrocita (blu) che convergono nella sinapsi (giallo). Fonte: Villanueva et al.
Degli scienziati hanno creato una delle immagini 3D più dettagliate della sinapsi, il punto di congiunzione importante dove i neuroni comunicano tra loro scambiandosi segnali chimici. Questi modelli in scala di nanometro aiuteranno gli scienziati a comprendere e studiare meglio le malattie neurodegenerative come l'Huntington e la schizofrenia.
Il nuovo studio, apparso su PNAS, è opera di un team guidato da Steve Goldman MD/PhD, condirettore del Center for Translational Neuromedicine dell'Università di Rochester, e dall'Università di Copenaghen. I risultati rappresentano un risultato tecnico significativo che consente ai ricercatori di studiare le diverse cellule che convergono alle singole sinapsi, a un livello di dettaglio finora non realizzabile.
"Una cosa è comprendere la struttura della sinapsi dalla letteratura, ma è un'altra vedere con i tuoi occhi la geometria precisa delle interazioni tra singole cellule", ha affermato Abdellatif Benraiss PhD, professore associato di ricerca al Center for Translational Neuromedicine e coautore dello studio. "La capacità di misurare questi ambienti estremamente piccoli è un campo giovane e con il potenziale di far avanzare la comprensione di una serie di malattie neurodegenerative e neuropsichiatriche in cui la funzione sinaptica è disturbata".
I ricercatori hanno usato la nuova tecnica per confrontare il cervello di topi sani con altri portatori del gene mutante che causa l'Huntington. La ricerca precedente nel laboratorio di Goldman aveva dimostrato che gli astrociti disfunzionali hanno un ruolo chiave nella malattia. Gli astrociti sono membri di una famiglia di cellule di supporto nel cervello chiamate glia e aiutano a mantenere l'ambiente chimico adeguato nella sinapsi.
I ricercatori si sono concentrati su sinapsi che coinvolgono motoneuroni spinosi medi, la cui perdita progressiva è un segno distintivo dell'Huntington. I ricercatori hanno dovuto prima identificare le sinapsi nascoste all'interno del groviglio delle tre diverse cellule che convergono nel sito: l'assone pre-sinaptico da un neurone distante, il suo obiettivo (il motoneurone spinoso medio post-sinaptico) e i processi in fibra di un astrocita vicino.
Per fare ciò, gli investigatori hanno impiegato virus per marcare separatamente a fluorescenza gli assoni, i motoneuroni e gli astrociti. Hanno quindi rimosso [le cellule da]i cervelli, visualizzato le aree di interesse mediante microscopia multifotonica e usato una tecnica chiamata 'infrared branding' (marcatura a infrarossi) che impiega laser per creare punti di riferimento nel tessuto cerebrale, permettendo ai ricercatori di ri-trasferire in seguito le cellule di interesse.
Il team ha quindi esaminato il tessuto cerebrale con un microscopio elettronico a scansione a blocchi seriali situato all'Università di Copenaghen, uno strumento di ricerca creato per studiare le strutture più piccole del cervello. Il dispositivo usa un coltello a diamante per rimuovere in serie e visualizzare fette ultrafini di tessuto cerebrale, creando modelli 3D in scala nanometrica delle cellule marcate e le loro interazioni nella sinapsi.
"I modelli rivelano la geometria e le relazioni strutturali tra gli astrociti e le loro sinapsi collegate, il che è importante perché queste cellule devono interagire in modo specifico nella sinapsi", ha affermato Carlos Benitez Villanueva PhD, associato senior al Center for Translational Neuromedicine e primo autore dello studio. "Questo approccio ci dà la capacità di misurare e descrivere la geometria dell'ambiente sinaptico e di farlo come funzione della malattia gliale".
Nel cervello di topi sani, il team ha osservato che i processi astrocitici hanno impegnato lo spazio attorno alla sinapsi a forma di disco, e l'hanno completamente avvolto, creando un legame stretto. Al contrario, gli astrociti nei topi di Huntington non erano così efficaci nell'ingaggiare o sigillare la sinapsi, lasciando grandi lacune. Questo difetto strutturale consente al potassio e al glutammato, prodotti chimici che regolano la comunicazione tra le cellule, di fuoriuscire dalla sinapsi, interrompendo potenzialmente la normale comunicazione cellulare.
La disfunzione degli astrociti è stata collegata ad altre condizioni, tra cui la schizofrenia, la sclerosi laterale amiotrofica e la demenza frontotemporale. I ricercatori ritengono che questa tecnica possa farci capire molto meglio le basi strutturali precise di quelle malattie. In particolare, sottolineano che questa tecnica potrebbe essere usata per valutare l'efficacia delle strategie di sostituzione delle cellule, che rimpiazza cellule gliali malate con altre sane, per il trattamento di queste malattie.
Fonte: Mark Michaud in University of Rochester (> English) - Traduzione di Franco Pellizzari.
Riferimenti: C Benitez Villanueva, [+4], SA Goldman. Astrocytic engagement of the corticostriatal synaptic cleft is disrupted in a mouse model of Huntington’s disease. PNAS, 2023, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.










 Associazione Alzheimer OdV
Associazione Alzheimer OdV