Il cervello ha un meccanismo naturale di protezione contro il morbo di Alzheimer (MA), e i ricercatori del Baylor College of Medicine, del Texas Children’s Hospital e di istituzioni che hanno collaborato, hanno scoperto che la variante genetica associata al rischio di sviluppare la malattia disturba il meccanismo di protezione in modi che possono portare alla neurodegenerazione.
I ricercatori hanno anche dimostrato, in un moscerino della frutta modello, che una sostanza chimica nota come 'agonista ABCA1' può ripristinare alcune alterazioni del meccanismo di protezione cerebrale.
Il team ha trovato evidenze che confermano che le specie reattive dell'ossigeno (ROS), sottoprodotti naturali del metabolismo cellulare legate all'infiammazione e ad altri processi, sono attori cruciali negli eventi che portano alla rottura del meccanismo neuroprotettivo. Inoltre, i ricercatori hanno scoperto che le ROS, insieme all'amiloide-beta (Aβ), il componente principale delle placche presenti nel cervello delle persone con MA, accelerano lo sviluppo della malattia nei modelli animali.
Complessivamente, i risultati forniscono una nuova visione meccanicistica dei fattori coinvolti nello sviluppo del MA, che danno supporto all'idea che diverse alterazioni a livello sia genetico che cellulare si combinano per indurre la malattia. Lo studio è pubblicato su PNAS-Proceedings of the National Academy of Sciences.
Il primo autore dott. Matthew Moulton, postdottorato del laboratorio del dott. Hugo Bellen, ha detto:
“Il lavoro precedente condotto dalla dott.ssa Lucy Liu nel nostro laboratorio e dai colleghi, ha dimostrato che due tipi di cellule cerebrali, i neuroni e le glia, lavorano insieme per proteggere dalla neurodegenerazione.
"In questo studio, abbiamo lavorato con moscerini della frutta e mammiferi, modelli di MA, per indagare se i fattori di rischio genetici noti per il MA sono associati al disturbo del meccanismo di protezione, andando in profondità nei dettagli di come accade tutto questo”.
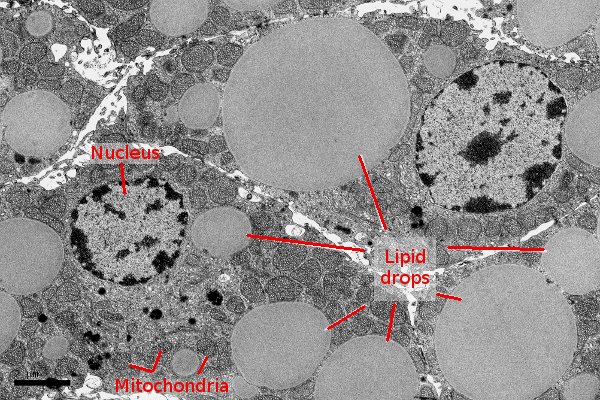
Il meccanismo neuroprotettivo è attivato quando i neuroni fronteggiano livelli alti di ROS, che stimolano i neuroni a produrre lipidi in abbondanza. I livelli di ROS aumentano con l'invecchiamento, con varie forme di stress o a causa di fattori genetici. La combinazione tra ROS e lipidi produce lipidi perossidati, che deteriorano la salute cellulare.
I neuroni cercano di evitare il danno secernendo questi lipidi, che le apolipoproteine (proteine che trasportano i lipidi) portano alle cellule gliali. Le glia immagazzinano i lipidi in goccioline lipidiche, li sequestrano dall'ambiente, impedendo così che danneggino i neuroni.
Nel precedente lavoro, i ricercatori avevano collegato il meccanismo neuroprotettivo al fattore di rischio genetico più forte del MA, l'apolipoproteina ApoE4. Bellen, professore di genetica molecolare ed umana al Baylor, ha detto:
“Abbiamo scoperto che l'ApoE4 è in pratica incapace di trasferire i lipidi alle glia, mentre altre due forme di ApoE, la 2 e la 3, effettuano il trasferimento in modo efficace. Con l'ApoE4, l'accumulo di goccioline di lipidi nelle cellule gliali si riduce drasticamente e il meccanismo di protezione si guasta. Questa differenza fondamentale nella funzione dell'ApoE4 probabilmente provoca una maggiore sensibilità dell'individuo agli effetti dannosi dei ROS, sensibilità che aumenta con l'età”.
Moulton ha detto:
“Nel lavoro attuale, volevamo identificare i geni che sono fondamentali per la formazione di goccioline di lipidi, in particolare i geni che sono necessari per esportare i lipidi dai neuroni e importarli nelle glia. Abbiamo esaminato i geni che interagiscono con l'ApoE nei neuroni per estromettere i lipidi, e anche nelle glia per importarli.
"Una ragione per cui eravamo interessati a questo viene da studi sull'uomo che dimostrano che i geni coinvolti sia nell'importazione che nell'esportazione dei lipidi sono implicati nel MA e in altre patologie correlate”.
Il team ha studiato il ruolo di questi geni di rischio di MA in un moscerino della frutta modello, un gene alla volta. Il modello ha consentito loro di visualizzare, in presenza o assenza di ROS, l'effetto che ha l'abbattimento di un particolare gene, nei neuroni o nelle glia, sulla formazione di goccioline lipidiche, nonché sulla neurodegenerazione.
“In tutti i casi in cui erano presenti ROS e abbiamo visto perdita di goccioline, abbiamo visto anche neurodegenerazione, confermando ancora che le perturbazioni nella formazione delle goccioline nelle glia possono portare al danno neuronale”, ha detto Moulton.
Con questo approccio, il team ha dimostrato che diversi geni associati al rischio di MA dal sequenziamento dell'intero genoma, disturbano la formazione neuroprotettiva di goccioline di lipidi, fornendo un meccanismo che può spiegare il rischio associato a questi geni.
Inoltre, usando il moscerino della frutta modello, Moulton e i suoi colleghi hanno testato se un agonista ABCA1, che in precedenza aveva dimostrato di ripristinare la capacità dell'ApoE4 di trasferire i lipidi, potrebbe consentire all'ApoE4 di mediare la formazione di goccioline di lipidi nelle cellule gliali nel moscerino della frutta. Bellen ha detto:
“L'agonista ABCA1 ha ripristinato la formazione gliale di goccioline di lipidi in un modello animale di ApoE4, mettendo in evidenza una strada terapeutica potenziale per prevenire la neurotossicità indotta dalle ROS”.
I ricercatori hanno anche esaminato se le ROS possono esacerbare l'effetto che l'Aβ può avere sulla malattia. Moulton ha detto:
“Abbiamo osservato che ROS e Aβ insieme aumentano la morte neuronale nei moscerini della frutta e risultano in placche ricche di Aβ più grandi e più numerose in un topo modello, suggerendo che, in effetti, ROS e Aβ possono interagire e influenzare potenzialmente la progressione della malattia”.
Bellen riassume:
“Con l'avanzare dell'età, le ROS nel cervello aumentano. Se in più ci sono le mutazioni che distruggono i percorsi delle goccioline, allora i neuroni possono diventare sensibili all'accumulo di goccioline lipidiche e questo può aprire la strada alla neurodegenerazione.
“I nostri risultati giustificano ulteriori indagini sui mezzi possibili per ridurre i livelli di ROS nel cervello, come strategia per ridurre al minimo il contributo fondamentale delle ROS alla neurodegenerazione”.
Fonte: Molly Chiu in Baylor College of Medicine (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Matthew Moulton, Scott Barish, Isha Ralhan, Jinlan Chang, Lindsey Goodman, Jake Harland, Paul Marcogliese, Jan Johansson, Maria Ioannou, Hugo Bellen. Neuronal ROS-induced glial lipid droplet formation is altered by loss of Alzheimer’s disease–associated genes. PNAS, 2021, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.











 Associazione Alzheimer OdV
Associazione Alzheimer OdV