 Ronald Zuckermann (sinistra) e Michael Connolly con un modello di proteina disposto a foglietto beta (Foto: Marilyn Sargent)
Ronald Zuckermann (sinistra) e Michael Connolly con un modello di proteina disposto a foglietto beta (Foto: Marilyn Sargent)
Al momento non ci sono trattamenti efficaci per le malattie da prioni, una famiglia di malattie neurodegenerative fatali causate dall'accumulo di copie mal ripiegate di una proteina naturale. Ma ora, c'è finalmente un modo efficace per rilevarle.
Come riferito nella rivista PLoS ONE, un team di scienziati che lavorano da quasi 20 anni alla rilevazione dei prioni hanno dimostrato che il loro approccio unico, basato su molecola sintetica, è in grado di isolare le proteine prioniche nei fluidi corporei campionati da animali infetti.
Questa scoperta, che conferma che il loro test è l'unico metodo di test pubblicato capace di rilevare in modo rapido e non invasivo i prioni nei soggetti viventi, è una pietra miliare importante nell'evoluzione di una tecnologia biomedica con applicazioni di ampio respiro.
Ronald Zuckermann, pioniere del peptoidi, membro fondatore del team di ricerca e scienziato senior della Molecular Foundry del Lawrence Berkeley National Laboratory, ha detto:
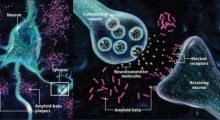
“Le nostre perle peptoidi hanno la capacità di rilevare le proteine mal ripiegate che sono agenti infettivi, così da avere un impatto significativo nel campo delle malattie da prioni; ma abbiamo anche dimostrato che può cercare le grandi proteine aggregate che sono agenti di malattia nell'Alzheimer e nel Parkinson, tra le altre.
“Le malattie da prioni sono rare, ma ci sono molte malattie provocate da proteine mal ripiegate, che colpiscono milioni di persone, e che sono anche molto poco conosciute. E come per le malattie da prioni, abbiamo bisogno di un modo per diagnosticare queste condizioni a lenta insorgenza negli anni prima che si presentino i sintomi”.
I peptoidi sono composti artificiali fatti per imitare i peptidi, le brevi catene di amminoacidi che sono gli elementi costitutivi della proteina. Le perle del team sono piccoli magneti rivestiti di peptoidi che imitano una parte della proteina prionica. Quando sono aggiunti ad un campione liquido, le unità di perle peptoidi si attaccano agli aggregati di proteine prioniche mal ripiegate, ma non toccano le proteine normali.
“È come il Velcro”, ha detto il co-autore Michael Connolly, ingegnere scientifico senior del gruppo di nanostrutture biologiche della Molecular Foundry. “La proteina misfolded [mal ripiegata] aggregata ha più ganci - siti multipli di legame - che si attaccano alla perla, che è come il foglio complementare. Ma la proteina naturale correttamente ripiegata ha un solo gancio, quindi la sua affinità di legame è molto minore“.
Una volta legate, le proteine mal ripiegate sono tirate fuori magneticamente dal liquido, e passano attraverso un test chiamato 'saggio per proteina malripiegata' (MPA, misfolded protein assay), che è stato sviluppato da scienziati della Novartis e dall'autore senior Adriano Aguzzi, neuropatologo ed esperto rinomato di malattie da prioni.
Il primo autore Simone Hornemann, ricercatore senior del gruppo di Aguzzi all'Istituto di Neuropatologia dell'Ospedale universitario di Zurigo, ha detto:
“Oltre a rilevare potenzialmente i vettori della malattia asintomatica, le perle-peptoidi MPA potrebbero essere ottimizzate per esaminare il sangue e i suoi prodotti in modo economico e veloce, una capacità che sarà molto importante per evitare la trasmissione accidentale in caso di una nuova epidemia di malattie da prioni“ .
“Questo test potrebbe anche essere modificato per testare cervi e alci per la 'malattia del dimagrimento cronico' (CWD), una malattia da prioni che è considerata un'epidemia globale in questi animali”.
Lo strano mondo dei prioni
Chiamate formalmente 'encefalopatie spongiformi trasmissibili' (TSE, transmissible spongiform encephalopathies), le malattie da prioni sono presenti in molte specie di mammiferi. Esse di solito insorgono quando, per ragioni sconosciute, le proteine prioniche dell'individuo cominciano ad assumere una particolare forma malripiegata, e poi, attraverso un meccanismo molecolare misterioso, agiscono come agenti infettivi inarrestabili che inducono altre copie normali della proteina prionica ad assumere la stessa forma mal ripiegata e si attaccano insieme in gruppi.
Questi grovigli di proteine si depositano in tutto il sistema nervoso, creando un modello diffuso di morte cellulare che dà al tessuto cerebrale un caratteristico aspetto spugnoso. Anche se questa forma “sporadica” è la più comune, le malattie da prioni possono sorgere anche da una mutazione genetica ereditaria della proteina prione, o dall'esposizione ad una proteina prionica malripiegata di un altro individuo, comprese quelle di una specie differente.
Ritenute un tempo stranezze mediche separate e isolate, la comunità scientifica ha cominciato collegare i punti tra le molte forme di malattie da prioni a metà del 20° secolo e, infine, ha identificato la proteina prionica sottostante nel 1985. Eppure, anche dopo questa scoperta è rimasto difficoltoso lo sviluppo di test diagnostici e di possibili trattamenti, per non parlare dello studio delle condizioni. Il più grande ostacolo è che tutti gli individui affetti hanno concentrazioni estremamente basse di proteina mal ripiegata nel sangue e negli altri fluidi, ma la forma normale della proteina è presente in abbondanza.
Poi, alla fine del 1980, un focolaio rilevante di encefalopatia spongiforme bovina (notoriamente conosciuto come 'morbo della mucca pazza') nei bovini europei e diverse centinaia di casi associati nell'uomo, hanno evidenziato quanto rapidamente possono diffondersi le malattie da prioni, dato il commercio globalizzato di prodotti biologici. Questi eventi hanno stimolato la comunità medica a dare la priorità alla ricerca di un test efficiente, producibile in grande quantità, che potesse essere usato per individuare la presenza di prioni nei pazienti viventi, nei cibi e nelle merci di origine animale.
Un approccio innovativo
Fu durante questo movimento scientifico urgente che Zuckermann, Connolly e Aguzzi hanno iniziato a collaborare.
“Negli anni '90, eravamo in una società, che ora fa parte della Novartis, che era interessata a rilevare questi tipi di malattie del sangue, e al momento questo sembrava abbastanza inverosimile“, ha detto Zuckermann. Oltre ad essere abbastanza sensibile per isolare i bassi livelli di prioni e sufficientemente specifico per non generare falsi positivi dalla proteina normale, qualsiasi legante potenziale deve essere in grado di resistere agli enzimi proteolitici degradanti che sono naturalmente in circolo nel sangue.
“Il compito diagnostico sembrava semplice perché questo è un aggregato della stessa proteina che vuole legarsi a sé stessa; così se semplicemente attacchi uno dei suoi peptidi a una perla o a un anticorpo, si dovrebbe legare automaticamente“, ha detto Zuckermann. Connolly continua a spiegare, “ma altri gruppi hanno continuato a incorrere in problemi perché tali proteine leganti venivano scomposte prima che potesse essere completata un'analisi. Si sono rivolti a me e a Ron perché abbiamo dimostrato che si potrebbe produrre un analogo che non si degrada“.
Dopo che i primi esperimenti su sangue e plasma si sono dimostrati promettenti, gli autori hanno intrapreso una serie di studi per dimostrare formalmente la sua efficacia. Attraverso queste indagini, che alla fine hanno portato all'attuale studio, Zuckermann, Connolly e i loro collaboratori alla Novartis hanno dimostrato che i peptoidi si legano a vari prioni animali e ad altri aggregati proteici che causano malattie.
Mentre si stava svolgendo questa ricerca, nel 2006, Zuckermann e Connolly sono entrati in Molecular Foundry per fondare l'impianto di nanostrutture biologiche. Da allora hanno sviluppato una tecnica di sintesi automatizzata che può produrre in serie peptoidi di qualsiasi sequenza desiderata, una capacità unica offerta alla comunità scientifica attraverso il programma utente di Molecular Foundry.
“Abbiamo capito fin dall'inizio che la loro utilità va molto oltre i prioni”, ha detto Zuckermann. “Così io e Michael abbiamo creato una risorsa qui al Berkeley Lab, dove siamo in grado di progettare e produrre peptoidi per qualsiasi campo, che sia biomedicale, energia o dei nanomateriali”.
Questa ricerca è stata finanziata dalla Fondazione Novartis Research e il lavoro alla Molecular Foundry è stato supportato dal DOE Office of Science. Gli altri autori sono Petra Schwarz ed Elisabeth J. Rushing, dell'Università di Zurigo e Alice Y. Yam di Novartis Vaccines and Diagnostics.
Fonte: Aliyah Kovner in Berkeley Lab (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Simone Hornemann, Petra Schwarz, Elisabeth J. Rushing, Michael D. Connolly, Ronald N. Zuckermann, Alice Y. Yam, Adriano Aguzzi. Enhanced detection of prion infectivity from blood by preanalytical enrichment with peptoid-conjugated beads. PLOS One, 12 Sep 2019, DOI
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.







 Associazione Alzheimer OdV
Associazione Alzheimer OdV