Le placche amiloidi, gli agglomerati appiccicosi che si accumulano dentro e attorno ai neuroni nel cervello, sono da tempo ritenute un indicatore del morbo di Alzheimer (MA). La maggior parte degli studi clinici sui farmaci per il trattamento della malattia degenerativa sono falliti, presumibilmente perché hanno preso di mira queste placche.
Ma secondo Raymond Anderson, ricercatore della West Virginia University, tale accumulo da solo non è correlato alla gravità della malattia. In effetti, questi accumuli possono persino proteggere i neuroni.
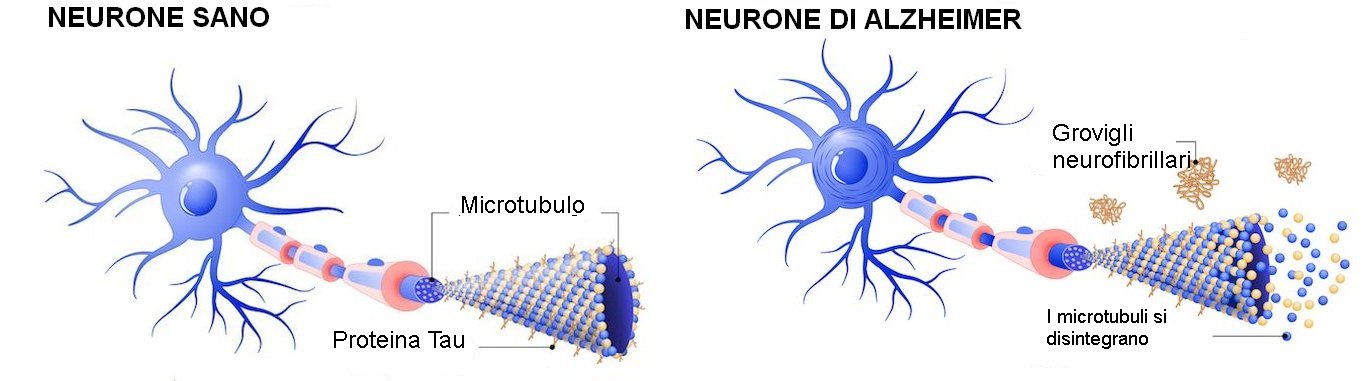
I National Institutes of Health gli hanno assegnato $ 132.000 in tre anni per esplorare un altro colpevole: una forma specifica della proteina tau, che può sabotare la capacità dei neuroni di scomporre e rimuovere le proteine danneggiate.
La tau di per sé non è dannosa. In effetti, essa conferisce stabilità all'assone, che fa parte del neurone. Anderson ha paragonato la tau ai cavi del Golden Gate Bridge. Ha spiegato che se un segmento di tau si annoda o si ripiega male, e si stacca dal "ponte", può "fluttuare nella cellula, scatenando il caos".
Egli studierà come una forma di tau libera di fluttuare e mal ripiegata altera la capacità della cellula di rottamare le vecchie proteine, che è importante per mantenere sani i neuroni. Determinerà anche se, rivitalizzando il processo di degradazione delle proteine delle cellule, può proteggere i neuroni dagli effetti neurotossici della tau.
"Da molto tempo, i ricercatori pensano che questi accumuli neurofibrillari (grovigli) di tau siano forme tossiche, ma in realtà ci sono segnali che potrebbero essere neuroprotettivi, attaccandosi alla tau tossica liberamente galleggiante, e sequestrandola nel groviglio neurofibrillare", ha detto Anderson.
L'idea che la forma di tau liberamente fluttuante e mal ripiegata sia tossica e che la tau intrappolata sia protettiva genera ancora polemiche tra i ricercatori, ma potrebbe arrivare a una più ampia accettazione.
Se Anderson riuscirà a individuare il modo in cui la tau inibisce il processo di degradazione della proteina, la scoperta potrà portare a farmaci che impediscono di interferire con una degradazione proteica sana o aiutare le cellule a compensarla.
"Anche se ci aspettiamo che questa forma tossica di tau studiata da Anderson contribuisca alla disfunzione neuronale nell'MA, sembra anche che questa possa essere solo la punta dell'iceberg, dal momento che abbiamo trovato anche altre proteine contaminate dal Parkinson e dall'Huntington con meccanismi d'azione simili", ha detto David Smith, professore associato di biochimica alla WVU e supervisore della ricerca di Anderson.
"Ci sono molti modi in cui è possibile inibire il degrado delle proteine", ha detto Anderson. "Mi piace questa ricerca perché mi dà l'opportunità di mettere in evidenza i meccanismi molecolari precisi della tossicità della tau sui giganteschi macchinari molecolari responsabili della degradazione delle proteine".
Fonte: West Virginia University (> English text) - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali colelgamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.









 Associazione Alzheimer OdV
Associazione Alzheimer OdV