 Scienziati della Washington University di St. Louis hanno dettagliato la struttura di una molecola che è implicata nell'Alzheimer.
Scienziati della Washington University di St. Louis hanno dettagliato la struttura di una molecola che è implicata nell'Alzheimer.
Conoscendo la forma della molecola, e il modo in cui la sua forma può essere rotta da alcune mutazioni genetiche, si può capire come si sviluppa l'Alzheimer e altre malattie neurodegenerative e come prevenirle e trattarle.
Lo studio è stato pubblicato ieri, 20 dicembre, sulla rivista eLife.
L'idea che la molecola TREM2 è coinvolta nel declino cognitivo - il segno distintivo delle malattie neurodegenerative, compreso l'Alzheimer - ha avuto un notevole sostegno negli ultimi anni.
Studi precedenti avevano dimostrato che alcune mutazioni che alterano la struttura della TREM2 sono associate ad un rischio più alto di sviluppare l'Alzheimer ad esordio tardivo, la demenza fronto-temporale, il Parkinson e la sclerosi laterale amiotrofica sporadica (SLA). Altre mutazioni della TREM2 sono legate alla malattia di Nasu-Hakola, una condizione ereditaria rara che provoca demenza progressiva e morte nella maggior parte dei pazienti verso i 50 anni.
"Non sappiamo esattamente quali disfunzioni provoca la TREM2 per contribuire alla neurodegenerazione, ma sappiamo che l'infiammazione è il filo conduttore di tutte queste condizioni", ha detto l'autore senior Thomas J. Brett PhD, assistente professore di medicina. "Il nostro studio ha esaminato queste mutazioni nella TREM2 e si è chiesto che cosa fanno alla struttura della proteina stessa, e come questo potrebbe influire sulla sua funzione. Capendo questo, si può cominciare a cercare le possibili correzioni".
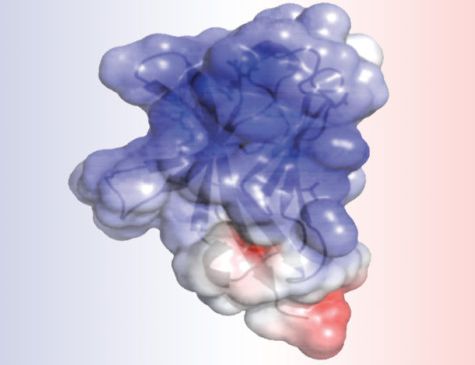
L'analisi della struttura della TREM2, completata dal primo autore, Daniel L. Kober, studente di dottorato nel laboratorio di Brett, ha rivelato che le mutazioni associate all'Alzheimer alterano la superficie della proteina, mentre quelle legate alla Nasu-Hakola influenzano le "viscere" della proteina. La differenza dell'intervento potrebbe spiegare la gravità di Nasu-Hakula, nella quale i segni di demenza iniziano in giovane età adulta.
Le mutazioni interne rompono completamente la struttura della TREM2, con il risultato di avere un minor numero di molecole TREM2. Le mutazioni di superficie, al contrario, lasciano la TREM2 intatta, ma probabilmente rendono più difficile per la molecola connettersi alle proteine o inviare segnali come farebbero le normali molecole TREM2.
La TREM2 si trova sulla superficie delle cellule immunitarie chiamate microglia, ritenute importanti cellule di 'manutenzione'. Attraverso un processo chiamato fagocitosi, tali cellule inghiottono e ripuliscono i rifiuti cellulari, compresa l'amiloide-beta che si accumula nell'Alzheimer. Se le microglia non hanno TREM2, o quelle presenti non funzionano correttamente, le 'domestiche cellulari' non possono svolgere le loro attività di pulizia.
"Quello che fa esattamente la TREM2 è ancora una questione aperta", ha detto Brett. "Sappiamo che i topi senza TREM2 hanno difetti alle microglia, che sono importanti per mantenere una biologia sana nel cervello. Ora che abbiamo queste strutture, possiamo studiare come funziona, o no, la TREM2 in queste malattie neurodegenerative".
La TREM2 è implicata anche in altre condizioni infiammatorie, tra cui la broncopneumopatia cronica ostruttiva e l'ictus, rendendo la sua struttura importante per comprendere malattie croniche e degenerative in tutto il corpo, ha aggiunto.
Fonte: Julia Evangelou Strait in Washington University (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Daniel L Kober, Jennifer M Alexander-Brett, Celeste M Karch, Carlos Cruchaga, Marco Colonna, Michael J Holtzman, Thomas J Brett. Neurodegenerative disease mutations in TREM2 reveal a functional surface and distinct loss-of-function mechanisms. eLife, 2016; 5 DOI: 10.7554/eLife.20391
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.










 Associazione Alzheimer OdV
Associazione Alzheimer OdV