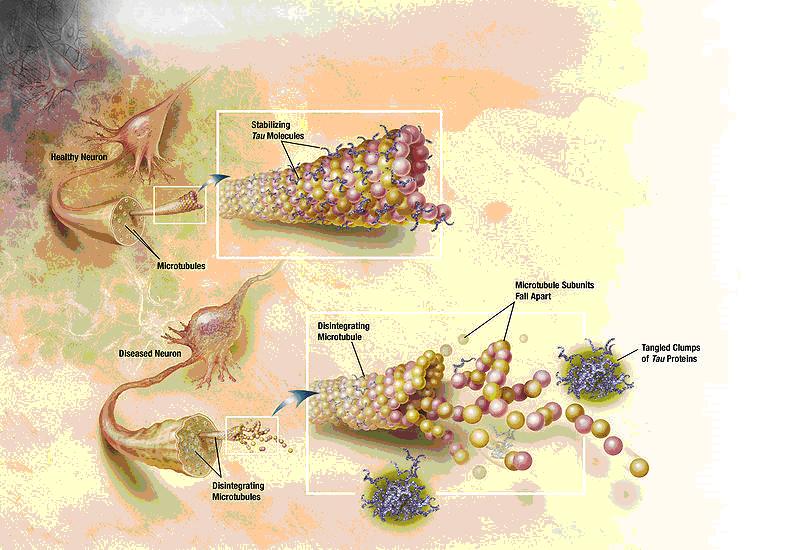
 La proteina tau associata ai microtubuli ha una complessa biologia, che comprende più varianti di splicing e siti di fosforilazione. La tau è un componente chiave dei microtubuli, che contribuiscono alla stabilità neuronale. Nell'Alzheimer la tau cambia, inducendo i microtubuli a collassare, e le proteine tau si aggregano insieme per formare grovigli neurofibrillari. (Fonte: National Institute on Aging)
La proteina tau associata ai microtubuli ha una complessa biologia, che comprende più varianti di splicing e siti di fosforilazione. La tau è un componente chiave dei microtubuli, che contribuiscono alla stabilità neuronale. Nell'Alzheimer la tau cambia, inducendo i microtubuli a collassare, e le proteine tau si aggregano insieme per formare grovigli neurofibrillari. (Fonte: National Institute on Aging)
La proteina tau associata ai microtubuli aiuta a mantenere la stabilità e la flessibilità dei microtubuli negli assoni neuronali. Lo splicing alternativo del gene tau (MAPT) produce 6 isoforme della proteina tau nel cervello e molte di più nel sistema nervoso periferico. La tau può essere fosforilata in oltre 30 siti, e subisce molte modifiche post-traslazionali per operare come substrato per più enzimi.
Tuttavia, la tau media anche funzioni patologiche tra cui la risposta e l'attacco neuroinfiammatorio, e la tossicità dell'amiloide-β (Aβ), e la patologia tau è una caratteristica di varie condizioni, compresa la demenza fronto-temporale, la lesione cerebrale traumatica (TBI), la sindrome di Down, la displasia fronto-corticale e l'Alzheimer (AD), così come di alcuni tumori e infezioni.
Il 18 settembre 2015, i relatori del simposio Alzheimer's Disease and Tau: Pathogenic Mechanisms and Therapeutic Approaches del Brain Dysfunction Discussion Group, hanno discusso i meccanismi con cui la tau diventa patologica e come si diffonde la patologia. Hanno anche descritto le strategie terapeutiche emergenti per AD focalizzate sulla tau.
La tau è onnipresente nel cervello, con effetti diffusi, ma è stata storicamente trascurata come forza-guida nell'AD. Nella sua introduzione al simposio, Robert Martone del St. Jude Childen's Research Hospital ha evidenziato l'attività e quello che emerge sulla tau come bersaglio di trattamento per questa malattia devastante.
La tau iperfosforilata (p-tau) è da tempo riconosciuta come un componente di principio dei grovigli neurofibrillari nell'AD; I monomeri di tau sono mal ripiegati in oligomeri che formano i filamenti tau. Come ha spiegato Hartmuth Kolb della Johnson & Johnson, lo sviluppo nel 2012 di un tracciante specifico-tau per la tomografia ad emissione di positroni (PET) ha portato a importanti intuizioni sulla presenza e la diffusione della patologia tau nel decorso delle tauopatie (compresa l'AD) negli esseri umani. In particolare, i ricercatori hanno dimostrato che la patologia tau si propaga attraverso il cervello con uno schema prevedibile, corrispondente alle fasi Braak di AD.
E' probabile che i sintomi di AD siano prodotti dagli effetti combinati delle patologie tau e Aβ.
George Bloom dell'Università della Virginia ha descritto come l'Aβ e la tau interagiscano, inducendo i neuroni maturi a rientrare nel ciclo cellulare, e portando alla morte cellulare. Nel cervello sano, l'insulina agisce come un portinaio che mantiene i neuroni adulti nella fase G0, dopo che le cellule escono definitivamente dal ciclo cellulare. Nell'AD, gli oligomeri amiloidi sequestrano i recettori neuronali dell'insulina, causando la resistenza all'insulina.
In parallelo, la fosforilazione della tau nei siti chiave (pY18-sito Fyn, pS409-sito PKA, PS416-sito CAM Kinase, e pS262) guidano la segnalazione mTOR alla membrana plasmatica, ma non al lisosoma, con conseguente rientro nel ciclo cellulare. In una cellula normale, l'attivazione di mTOR nel lisosoma prevale sul segnale di rientro nel ciclo cellulare, creando un importante meccanismo di regolazione per mantenere i neuroni sani.
Tuttavia, l'attivazione del mTOR lisosomiale è insulino-dipendente e quindi è colpita dall'insensibilità all'insulina indotta da Aβ. Gli oligomeri amiloidi, tramite regolazione dell'insulina, mollano i freni su una cascata di eventi guidati dalla p-tau che conduce al rientro del ciclo cellulare e alla morte cellulare.
Khalid Iqbal del «New York State Institute for Basic Research in Developmental Disabilities» ha descritto la ricerca che mostra la p-tau che si diffonde nel cervello in un modello di roditore, ben al di là del sito di iniezione, in modo simile a quello dei prioni, e che la diffusione della patologia può essere mitigata dall'aggiunta di PP2A, una fosfatasi nota per essere in quantità minore nella materia grigia e bianca dell'AD. La regolazione PP2A è danneggiata in AD, ictus, e acidosi cerebrale, fornendo un collegamento tra questi disturbi e la patologia tau.
La discussione della fisiopatologia di AD si concentra di solito sulle placche Aβ e sui grovigli neurofibrillari (NFT - NeuroFibrillary Tangles), composti da tau iperfosforilata mal assemblata; si è generalmente ritenuto che tali placche e grovigli siano le cause primarie dei sintomi. Tuttavia, recenti evidenze indicano che le varianti oligomeriche di tau sono in realtà molto più tossiche, sotto forma di tau presenti nei NFT.
Michael Hutton della Eli Lilly and Company studia le proprietà necessarie perchè la tau diventi patologica. Ha usato modelli animali per dimostrare che il "seme" della p-tau anormale, dal quale c'è una diffusione di tipo prionica, deve essere di alto peso molecolare (con almeno 3 unità Tau) e altamente fosforilato per indurre la tau sana a diventare patologica. Queste caratteristiche sono necessarie ma non sufficienti per una semina efficace.
C'è anche la prova che la patologia tau si propaga tramite un ciclo autocatalitico di aggregazione e frammentazione seminata. La propagazione, oltre a richiedere un elevato numero di unità p-tau aggregate, può essere influenzato dalla isomerizzazione di tali monomeri. Kun Ping Lu della Harvard Medical School ha fornito dati che suggeriscono che è la pT231-tau cis, e non la trans, il precursore della taupatia, che collega la TBI al successivo sviluppo di malattie neurodegenerative, come l'encefalopatia traumatica cronica e l'AD. Egli ha dimostrato il ruolo in questo processo della Pin1, una isomerasi prolyl specifica della fosforilazione, usando modelli animali di trauma cranico e AD.
La Pin1, che è regolata in risposta allo stress, evita l'accumulo di p-tau cis tossico per convertirlo nell'isoforma trans, ma questo processo è inibito in AD e TBI. Lu ha dimostrato che la capacità della p-tau cis di causare e diffondere la neurodegenerazione può essere bloccata da un anticorpo monoclonale p-tau cis in vitro e in modelli animali, indicando il potenziale terapeutico di colpire la p-tau cis per il trattamento del trauma cranico e dell'AD.
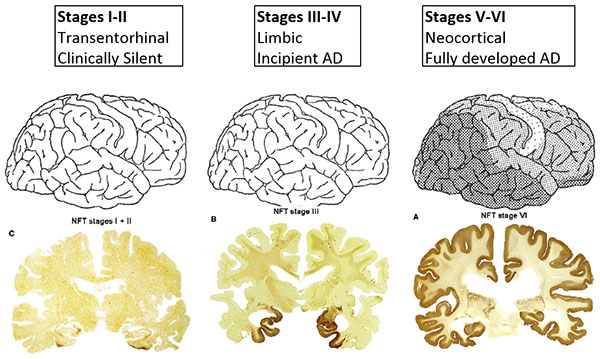 La patologia tau si diffonde nel cervello con un modello prevedibile. La proteina tau anomala si vede la prima volta nella regione transentorinale (fasi I e II) e si diffonde nelle regioni limbiche nelle fasi III e IV, quando cominciano ad essere visibili i primi segni di AD. La patologia si estende poi a tutta la neocorteccia, portando all'AD completo. Questa progressione è stato descritta da Braak e Braak nel 1991. (Fonte: Hartmuth Kolb)
La patologia tau si diffonde nel cervello con un modello prevedibile. La proteina tau anomala si vede la prima volta nella regione transentorinale (fasi I e II) e si diffonde nelle regioni limbiche nelle fasi III e IV, quando cominciano ad essere visibili i primi segni di AD. La patologia si estende poi a tutta la neocorteccia, portando all'AD completo. Questa progressione è stato descritta da Braak e Braak nel 1991. (Fonte: Hartmuth Kolb)
Allevare semi p-tau in vitro produce una vasta gamma di strutture tau aggregate.
Marc Diamond della University of Texas Southwestern Medical Center ha discusso le diverse strutture prodotte da diversi semi tau, che il suo team ha studiato in una serie di esperimenti usando modelli in vitro, modelli animali, e le analisi post-mortem umane. Il suo laboratorio ha dimostrato che conformazioni distinte di semi di aggregati si propagano in modo stabile, infettando le cellule normali e portandole ad acquisire aggregati tau anomali con strutture distinte e riproducibili e con diverse proprietà biochimiche. In un altro studio il team ha mostrato che la morfologia degli aggregati p-tau era correlata alla diagnosi. I semi provenienti da tessuti umani postmortem hanno prodotto fenotipi affidabili nella cultura, seguiti con diagnosi diverse, predicendo retroattivamente l'esito biologico. Pertanto, le caratteristiche del seme p-tau hanno una grande influenza sul risultato biologico, fornendo una nuova prospettiva per la diagnosi pre-sintomatica.
Con i meccanismi con cui si forma la p-tau, si converte la tau sana e si stabiliscono le disfunzioni dei semi, nasce la questione di come la p-tau esce dalla cellula e si muove nel cervello.
Il modello di propagazione e la velocità con cui la patologia progredisce suggerisce che la p-tau si propaga trans-sinapticamente. Nicole Leclerc dell'Università di Montreal ha fornito prove a sostegno di questa tesi. È probabile, come ha dimostrato il suo laboratorio, che la tau sia secreta e ripresa dai neuroni in un processo attivo, in risposta all'attività neuronale. La secrezione della tau in-vitro aumenta in condizioni quali l'inedia e la disfunzione lisosomiale, fenomeni presenti nelle prime fasi dell'AD. Inoltre, l'iperfosforilazione sembra aumentare il puntamento della tau sul percorso secretorio, accelerando potenzialmente la diffusione della p-tau. Curiosamente, tuttavia, la tau extracellulare è ipofosforilata, suggerendo una defosforilazione su larga scala durante il processo di secrezione. Questa ipo-tau può attivare i recettori muscarinici dell'acetilcolina, aumentando la Ca2+ intracellulare e promuovendo la morte cellulare.
Questi risultati suggeriscono che la sinapsi ha un ruolo critico nello sviluppo dell'AD; l'ambiente extrasinaptico è noto per essere squisitamente regolato dalle microglia. Il focus degli studi sulle malattie neurodegenerative è spesso sui neuroni, ma gli studi genetici hanno più volte identificato cambiamenti nell'espressione dei geni microgliali in AD, anche in uno dei principali geni candidati di AD (TREM2), dimostrando un fondamentale contributo di queste cellule all'AD.
Richard Ransohoff di Biogen ha discusso l'importanza di questo tipo di cellule. Le microglia entrano nel cervello intorno al giorno embrionale (E) 9.5 nei roditori e sono coinvolte in modo cruciale nel mantenimento della salute del cervello. Durante lo sviluppo le cellule svolgono un ruolo importante nella potatura sinaptica di larga scala necessaria per una efficace maturazione neuronale. Esse sono anche altamente reattive all'ambiente, e lo stress in età adulta può riattivare la potatura sinaptica delle microglia, un processo che è adattivo durante lo sviluppo, ma mal-adattivo in età adulta. Il processo è regolato da cascate del sistema di complemento. La TGF-β espressa dagli astrociti spinge i neuroni ad esprimere C1q presinapticamente, provocando l'accumulo di elementi di complemento nel sito, e in ultima analisi, inducendo le microglia a potare la connessione sinaptica.
Nell'AD l'attivazione impropria di questa cascata può portare alla rimozione delle connessioni altrimenti sane.
Ransohoff ha descritto il ruolo del CXCR3 (il recettore di fractalkine) nella regolazione della reattività della microglia, e quindi nel mitigare la potatura delle sinapsi adulte. La regolazione della reattività delle microglia è guidata da cambiamenti indotti epigeneticamente nei geni della risposta infiammatoria. Corrispondentemente, in assenza di CXCR3, la patologia tau è aggravata nei topi htau (che esprimono isoforme tau umane), suggerendo un effetto protettivo del percorso CXCR3. Ransohoff ha chiuso con l'avvertenza che le microglia non sono intrinsecamente utili o dannose; le loro proprietà dipendono dal contesto e devono essere svelate da osservazioni empiriche di modelli appropriati.
Peter Davies del Feinstein Institute for Medical Research ha discusso la necessità di integrare meglio le attuali conoscenze nel modello di progettazione della ricerca, in particolare per sviluppare anticorpi monoclonali per il trattamento di AD. Gli anticorpi monoclonali sono una strategia promettente, ma traducerre i risultati preclinici in risultati clinici di successo richiede un attento esame del contesto dei primi anni di ricerca. La maggior parte dei modelli animali transgenici per l'AD esprimono p-tau in tutti i neuroni, ma una diffusione così ampia della p-tau non si trova nel cervello AD umano. Ci sono diversi ostacoli per determinare l'efficacia e la sicurezza dei farmaci negli esseri umani; è difficile valutare la specificità e trovare dosaggi appropriati.
In una serie di studi con particolare attenzione alla riproducibilità esterna, Davies ha presentato prove su modelli animali che dimostrano che l'immunoterapia può bloccare la diffusione della p-tau, ma non può annullare la patologia già presente nel cervello. Nel topo modello di htau numerosi anticorpi putativi non hanno efficacia, e in alcuni casi sembrano peggiorare la patologia. Questi risultati sottolineano la necessità di modelli migliori e di una migliore comprensione dei meccanismi di azione prima di passare i farmaci alla clinica.
Fonte: Caitlin McOmish in The New York Academy of Sciences. Alzheimer's Disease and Tau: Pathogenic Mechanisms and Therapeutic Aβproaches. Academy eBriefings. 2015. Available at: www.nyas.org/Tau2015-eB
Pubblicato in The New York Academy of Sciences (> English text) - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.













 Associazione Alzheimer OdV
Associazione Alzheimer OdV