Genomica e studi di laboratorio rivelano numerosi fatti nuovi, tra cui un ruolo chiave della reelina per la vulnerabilità neuronale, e della colina e degli antiossidanti nel sopporto alla cognizione.
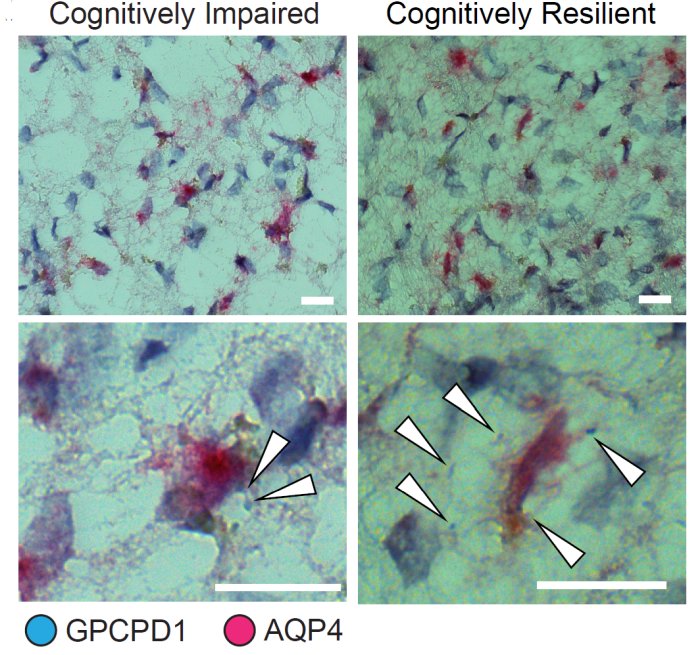 L'espressione del gene GPCPD1 negli astrociti è associata alla resilienza cognitiva nelle persone con Alzheimer. Le frecce bianche indicano istanze di espressione di GPCPD1 (blu) negli astrociti (magenta). C'è molta più espressione nei tessuti dalla persona cognitivamente resiliente (a destra).
L'espressione del gene GPCPD1 negli astrociti è associata alla resilienza cognitiva nelle persone con Alzheimer. Le frecce bianche indicano istanze di espressione di GPCPD1 (blu) negli astrociti (magenta). C'è molta più espressione nei tessuti dalla persona cognitivamente resiliente (a destra).
Uno studio eseguito al MIT di Boston, pubblicato su Nature, fornisce nuove prove su come cellule e circuiti specifici diventano vulnerabili nel morbo di Alzheimer (MA) e arriva ad altri fattori che possono aiutare alcune persone a essere resilienti al declino cognitivo, anche tra segni chiari di patologia della malattia.
Per evidenziare obiettivi potenziali per interventi che supportano la cognizione e la memoria, gli autori si sono impegnati in un nuovo confronto dell'espressione genica in più regioni cerebrali nelle persone con o senza MA e hanno condotto esperimenti di laboratorio per testare e convalidare i loro principali risultati.
Tutte le cellule cerebrali hanno lo stesso DNA, ma ciò che le rende differenti, sia per identità che per attività, sono i loro modelli di espressione di quei geni. La nuova analisi ha misurato le differenze di espressione genica in oltre 1,3 milioni di cellule di oltre 70 tipi diversi in 6 regioni cerebrali di 48 donatori di tessuti, 26 dei quali sono morti con una diagnosi di MA e 22 senza.
Così progettato, lo studio fornisce un resoconto unicamente grande, di vasta portata e però dettagliato, di come l'attività delle cellule cerebrali differisce nel MA per tipo di cellula, per regione cerebrale, per patologia della malattia e per valutazione cognitiva di ogni persona mentre era ancora in vita.
"Ci sono regioni cerebrali specifiche vulnerabili al MA e c'è un'importante necessità di capire come sono vulnerabili queste regioni o tipi particolari di cellule", ha affermato la coautrice senior Li-Huei Tsai, prof.ssa di neuroscienze e direttrice del Picower Institute for Learning and Memory e dell'Aging Brain Initiative al MIT. “E il cervello non è solo neuroni, ci sono molti altri tipi di cellule. Il modo in cui questi tipi di cellule possono rispondere in modo diverso, a seconda di dove si trovano, è qualcosa di affascinante che stiamo solo iniziando a esaminare".
Il coautore senior Manolis Kellis, professore di informatica e capo del gruppo di biologia computazionale del MIT, ha paragonato la tecnica utilizzata per misurare i confronti dell'espressione genica, la profilazione dell'RNA a cellula singola, a un 'microscopio' molto più avanzato di quelli che hanno permesso ad Alois Alzheimer di caratterizzare la patologia della malattia più di un secolo fa.
"Laddove Alzheimer ha visto placche di proteine amiloidi e grovigli di tau fosforilata nel suo microscopio, il nostro 'microscopio' a cella singola ci mostra, cellula per cellula e gene per gene, migliaia di sottili ma importanti cambiamenti biologici nella risposta alla patologia", ha detto Kellis. “Il collegamento di queste informazioni con lo stato cognitivo dei pazienti rivela come le risposte cellulari si relazionano con la perdita cognitiva o la resilienza e può aiutare a proporre nuovi modi per trattare la perdita cognitiva. La patologia può precedere i sintomi cognitivi di un decennio o due prima che il declino cognitivo venga diagnosticato. Se non c'è molto che possiamo fare sulla patologia in quella fase, possiamo almeno provare a salvaguardare i percorsi cellulari che mantengono la funzione cognitiva".
Hansruedi Mathys (ex postdottorato nel laboratorio della Tsai, ora professore associato all'Università di Pittsburgh), Carles Boix (ex ricercatore del laboratorio di Kellis e ora postdottorato ad Harvard) e Leyla Akay (ricercatrice del laboratorio della Tsai), hanno guidato lo studio, analizzando le corteccia prefrontale ed entorinale, l'ippocampo, il talamo anteriore, il giro angolare e la corteccia medio-temporale. I campioni del cervello provenivano dal Religious Order Study e dal Rush Memory and Aging Project della Rush University.
Vulnerabilità neurale e reelina
Alcuni dei primi segni di patologia amiloide e perdita di neuroni nel MA sono presenti nelle regioni focalizzate sulla memoria chiamate ippocampo e corteccia entorinale. In quelle regioni e in altre parti della corteccia cerebrale, i ricercatori hanno individuato un potenziale motivo di ciò: un tipo di neurone eccitatorio nell'ippocampo e 4 nella corteccia entorinale erano significativamente meno abbondanti nelle persone con MA rispetto alle persone senza. Gli individui con carenza di tali cellule sono andate significativamente peggio sulle valutazioni cognitive.
Inoltre, molti neuroni vulnerabili erano interconnessi in un circuito neuronale comune. E altrettanto importante, molti esprimevano direttamente una proteina chiamata reelina o erano direttamente influenzati dalla segnalazione della reelina. Nel complesso, quindi, i risultati evidenziano distintamente i neuroni particolarmente vulnerabili, la cui perdita è associata a una cognizione ridotta, che condividono un circuito neuronale e un percorso molecolare.
La Tsai ha osservato che la reelina è diventata importante nella ricerca di MA per merito di uno studio recente su un uomo in Colombia. Aveva una rara mutazione nel gene Reelin che induceva la proteina ad essere più attiva ed è rimasto cognitivamente sano fino in età avanzata, nonostante avesse una forte predisposizione familiare al MA ad esordio precoce.
Il nuovo studio mostra che la perdita di neuroni che producono reelina è associata al declino cognitivo. Nell'insieme ciò può significare che il cervello trae benefici dalla reelina, ma che i neuroni che la producono possono essere persi almeno in alcuni pazienti di Alzheimer. "Possiamo pensare che la reelina abbia una sorta di effetto protettivo o benefico", ha detto la Akay. "Ma non sappiamo ancora cosa fa o come potrebbe conferire resilienza".
Con ulteriori analisi, i ricercatori hanno scoperto che anche sottotipi di neuroni inibitori specificamente vulnerabili, identificati in uno studio precedente da questo gruppo nella corteccia prefrontale, erano coinvolti nella segnalazione della reelina, rafforzando ulteriormente il significato della molecola e la sua via di segnalazione.
Per verificare i risultati, il team ha esaminato direttamente i campioni di tessuto cerebrale umano e il cervello di due tipi di topi modello di MA. Come previsto, quegli esperimenti hanno anche mostrato una riduzione dei neuroni positivi alla reelina nella corteccia entorinale umana e nei topi.
Resilienza associata al metabolismo della colina negli astrociti
Per trovare fattori che potrebbero preservare la cognizione, anche nella patologia, il team ha esaminato quali geni, in quali cellule e in quali regioni, erano associati più strettamente alla resilienza cognitiva, che hanno definito 'funzione cognitiva residua', al di sopra della tipica perdita cognitiva prevista data la patologia osservata.
La loro analisi ha prodotto una risposta sorprendente e specifica: in diverse regioni cerebrali gli astrociti che esprimevano geni associati all'attività antiossidante e al metabolismo della colina e alla biosintesi di poliammina erano associati significativamente a cognizione sostenuta, anche con livelli elevati di tau e amiloide.
I risultati hanno rafforzato i precedenti risultati delle ricerche guidate da Tsai e Susan Lundqvist, con cui hanno dimostrato che l'integrazione alimentare di colina aiuta gli astrociti ad affrontare la disregolazione dei lipidi causati dal più significativo gene di rischio di MA, la variante ApoE4. Le scoperte sugli antiossidanti hanno anche indicato una molecola, disponibile pure come integratore alimentare, la spermidina, che può avere proprietà antinfiammatorie, sebbene tale associazione abbia bisogno di ulteriori lavori per essere stabilita causalmente.
Come prima, il team è andato oltre le previsioni dell'analisi dell'espressione dell'RNA a singola cellula per fare osservazioni dirette nel tessuto cerebrale dei campioni. Quelli che provenivano da individui cognitivamente resilienti hanno mostrato una maggiore espressione di molti dei geni espressi dagli astrociti previsti per essere associati alla resilienza cognitiva.
Nuovo metodo di analisi, set di dati aperto
Per analizzare le montagne di dati a cellula singola, i ricercatori hanno sviluppato una nuova solida metodologia basata su gruppi di geni espressi coordinati ('moduli genici'), sfruttando così i modelli di correlazione dell'espressione tra i geni correlati funzionalmente nello stesso modulo.
"In linea di principio, le 1,3 milioni di cellule che abbiamo esaminato potrebbero usare i loro 20.000 geni in un numero astronomico di combinazioni diverse", spiega Kellis. “In pratica, tuttavia, osserviamo un sottoinsieme molto più piccolo di cambiamenti coordinati. Riconoscere questi modelli coordinati ci consente di dedurre cambiamenti molto più robusti, poiché si basano su più geni nello stesso modulo collegato funzionalmente".
Egli ha espresso questa analogia: con le molte articolazioni del corpo, le persone potrebbero muoversi in molti modi folli, ma in pratica si impegnano in molti meno movimenti coordinati, come camminare, correre o ballare. Il nuovo metodo consente agli scienziati di identificare tali programmi di espressione genica coordinati come gruppo.
Mentre i laboratori di Kellis e Tsai hanno già riferito diversi risultati degni di nota dal set di dati, i ricercatori si aspettano che molte più scoperte, possibilmente significative, attendono ancora di essere trovate nei dati. Per facilitare tale scoperta, il team ha pubblicato utili strumenti analitici e di visualizzazione insieme ai dati sul sito Web di Kellis all'indirizzo: https://compbio.mit.edu/ad_muliregion.
“Il set di dati è immensamente ricco. Ci siamo concentrati solo su alcuni aspetti salienti che crediamo siano molto, molto interessanti, ma non abbiamo affatto esaurito ciò che può essere appreso da questo insieme di dati", ha detto Kellis. "Ci aspettiamo molte altre scoperte in seguito e speriamo che giovani ricercatori (di tutte le età) si immergano e ci sorprendano con molte altre intuizioni".
Per il seguito, ha affermato Kellis, i ricercatori stanno studiando i circuiti di controllo associati ai geni espressi in modo differenziato, per comprendere le varianti genetiche, i regolatori e altri fattori guida che possono essere modulati per invertire i circuiti della malattia tra le varie regioni cerebrali, i tipi di cellule e le fasi diverse della malattia.
Fonte: Picower Institute at MIT (> English) - Traduzione di Franco Pellizzari.
Riferimenti: H Mathys, [+18], M Kellis. Single-cell multiregion dissection of Alzheimer’s disease. Nature, 2024, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.








 Associazione Alzheimer OdV
Associazione Alzheimer OdV