La ricerca sul modo in cui una molecola chiave innesca la morte degli assoni può portare a nuove terapie.
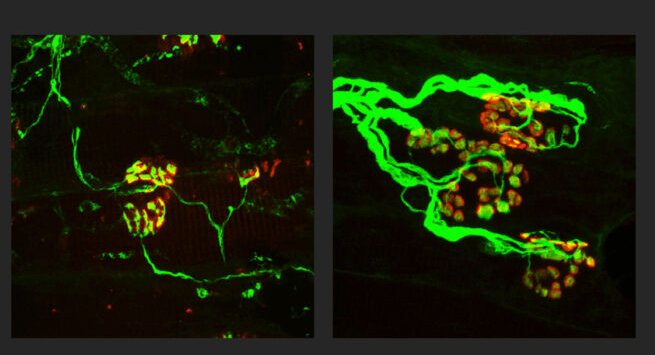 Gli assoni (verdi) sono più sottili in un topo modello di neuropatia periferica assonale ereditaria (a sinistra). Nei roditori con il disturbo, ma senza SARM1, gli assoni sono più spessi (a destra) e indistinguibili da assoni normali e sani.
Gli assoni (verdi) sono più sottili in un topo modello di neuropatia periferica assonale ereditaria (a sinistra). Nei roditori con il disturbo, ma senza SARM1, gli assoni sono più spessi (a destra) e indistinguibili da assoni normali e sani.
Due nuovi studi eseguiti alla Washington University di St. Louis danno slancio allo sviluppo di un trattamento di vasta applicabilità per le malattie neurodegenerative, che punta una molecola che funge da aguzzino centrale nella morte degli assoni, il cablaggio del sistema nervoso.
Il blocco di questo carnefice molecolare impedisce la perdita di assoni, che è implicata in molte malattie neurodegenerative, dalle neuropatie periferiche al Parkinson, e dal glaucoma alla sclerosi laterale amiotrofica (SLA).
I nuovi studi, entrambi pubblicati il 26 ottobre sul Journal of Clinical Investigation, rivelano dettagli sorprendenti su come la molecola - chiamata SARM1 - innesca la morte degli assoni che sta alla base dello sviluppo delle malattie neurodegenerative. La ricerca indica anche nuovi approcci terapeutici per le malattie definite da perdita di assoni.
Il coautore senior Jeffrey Milbrandt MD/PhD, professore e capo del Dipartimento di Genetica, ha dichiarato:
"Abbiamo disperatamente bisogno di trattamenti per le malattie neurodegenerative. Con l'evidenza del ruolo centrale della SARM1 in queste malattie, siamo molto interessati a trovare i modi per bloccare questa molecola, sia con inibitori a piccole molecole che con tecniche di terapia genica.
"La nostra ultima ricerca suggerisce che potremmo anche essere in grado di interferire con la sua capacità di guidare la neuroinfiammazione dannosa. Speriamo che questo lavoro porti a nuove efficaci terapie in una serie di malattie neurodegenerative e neuroinfiammatorie".
Nel 2017, Milbrandt e il coautore senior Aaron DiAntonio MD/PhD, professore di biologia dello sviluppo, hanno scoperto che SARM1 è un enzima che può promuovere la neurodegenerazione. Poco dopo, hanno co-fondato una società chiamata Disarm Therapeutics per velocizzare lo sviluppo di composti farmacologici che inibiscono SARM1 per il trattamento delle malattie caratterizzate dalla degenerazione degli assoni. Nel 2020, Disarm Therapeutics è stata acquisita dalla Eli Lilly & Co per promuovere lo sviluppo di terapie che puntano SARM1 per le malattie neurodegenerative.
Nei neuroni sani, il SARM1 è sempre spento, ma dopo una lesione o a causa di una malattia, diventa attivo. Il SARM1 attivato è un incendiario, brucia così tanta energia cellulare che gli assoni non riescono a sopravvivere. Questa crisi energetica induce gli assoni a disintegrarsi.
Per capire di più il ruolo di SARM1 nell'innesco della distruzione degli assoni, i ricercatori hanno studiato una sindrome di neuropatia progressiva, misteriosa ed estremamente rara, così rara che manca di un nome. Questa malattia rara si è rivelata un buon modello per comprendere il ruolo del sistema immunitario nelle condizioni neuroinfiammatorie in generale.
Sequenziando i genomi dei pazienti, i ricercatori hanno scoperto che la perdita di assoni era causata da errori genetici nel gene NMNAT2, la cui funzione normale mantiene disattivo il SARM1. A causa di questi errori genetici, il SARM1 è costantemente attivo, il che innesca la distruzione degli assoni. I ricercatori hanno usato la tecnica di modifica genetica CRISPR per riprodurre queste mutazioni nei topi. Come le persone con la sindrome, questi topi sono sopravvissuti all'età adulta ma hanno avuto un peggioramento della disfunzione motoria, la perdita di assoni periferici e, soprattutto, un'infiltrazione di cellule immunitarie chiamate macrofagi.
I ricercatori sono stati sorpresi di scoprire che riducendo il numero di macrofagi si sono invertiti la perdita di assoni e i sintomi della malattia nei topi. Lo studio suggerisce che il SARM1 non solo contribuisce direttamente alla perdita di assoni, ma ha anche un ruolo nella guida della neuroinfiammazione che serve solo a aggravare i problemi. I risultati suggeriscono anche che alcune condizioni neurodegenerative potrebbero essere trattate con farmaci che modulano l'immunità, bloccando i macrofagi o altre cellule immunitarie infiammatorie.
Nel secondo documento, i ricercatori hanno studiato il possibile ruolo di SARM1 nella malattia di Charcot-Marie-Tooth di tipo 2A, una forma comune di neuropatia periferica ereditaria e un buon modello per studiare la perdita degli assoni in generale. I pazienti con questa malattia hanno una perdita progressiva di assoni motori e sensoriali e sviluppano difficoltà a camminare, debolezza muscolare e formicolio o sensazioni di bruciore alle mani e ai piedi.
La malattia è causata da una mutazione in una proteina importante dei mitocondri, le fabbriche energetiche delle cellule. La mutazione, in una proteina chiamata mitofusin2, compromette la funzione normale dei mitocondri. Molte ricerche si sono concentrate sui mitocondri anormali, supponendo che debbano essere la radice del problema in questa malattia.
Sorprendentemente, i ricercatori hanno scoperto che l'eliminazione di SARM1 nei topi modello di malattia di Charcot-Marie-Tooth di tipo 2A ha bloccato la maggior parte dei problemi evidenziati dagli animali, indipendentemente dai mitocondri malati. L'eliminazione di SARM1 ha bloccato o rallentato la morte degli assoni, l'atrofia muscolare, le anomalie mitocondriali e i problemi alle giunzioni neuromuscolari, in cui i neuroni si interfacciano con i muscoli. Anche con la proteina mitofusin2 mutante presente, la cancellazione di SARM1 ha protetto i mitocondri da ulteriori degradazione e disfunzione.
"Quando blocchiamo SARM1, non solo proteggiamo gli assoni, ma otteniamo mitocondri molto più sani", ha detto DiAntonio. "Questa è stata una sorpresa assoluta, ma speriamo che possa essere rilevante in molte malattie neurodegenerative in cui il danno mitocondriale è centrale, come il Parkinson, poiché molte malattie neurodegenerative hanno una componente di disfunzione mitocondriale".
Fonte: Julia Evangelou Strait in Washington University(> English) - Traduzione di Franco Pellizzari.
Riferimenti:
- Y Yamada, ...[+3], A DiAntonio, J Milbrandt. A SARM1/mitochondrial feedback loop drives neuropathogenesis in a Charcot-Marie-Tooth disease type 2A rat model. Journal of Clinical Investigation, 2022, DOI
- CB Dingwall, ...[+10], J Milbrandt. Macrophage depletion blocks congenital SARM1-dependent neuropathy. Journal of Clinical Investigation, 2022, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.











 Associazione Alzheimer OdV
Associazione Alzheimer OdV