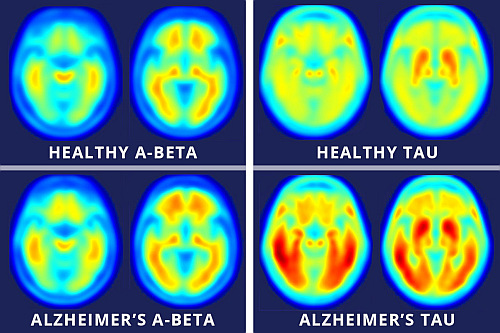
Il morbo di Alzheimer (MA), la forma più comune di demenza, attualmente non ha una cura o una terapia efficace, in parte a causa di lacune nella nostra comprensione di come nasce il disturbo neurodegenerativo progressivo nel cervello.
Ora, uno studio dell'Università Flinders ha dimostrato che una proteina chiamata tau, un fattore critico nello sviluppo del MA, si trasforma dallo stato normale a uno malato, e dimostra che questa scoperta potrebbe fornire un obiettivo terapeutico.
I risultati dello studio, pubblicato su Science Advances, forniscono la speranza di impedire che insorga il processo di trasformazione della tau, mantenendola in uno stato sano ed evitando i suoi effetti tossici sulle cellule cerebrali.
"Accanto a un piccolo peptide chiamato amiloide-beta, la proteina tau è un fattore centrale nel MA. La tau è necessaria perché ci siano gli effetti tossici sulle cellule cerebrali che si traducono nel deterioramento delle funzioni della memoria", afferma l'autore senior dello studio dott. Arne Ittner, ricercatore di neuroscienze della Flinders.
Nel corso dello sviluppo del MA, la tau si accumula in depositi all'interno delle cellule cerebrali. Durante questo processo, la tau viene fortemente modificata, e vari depositi costituiti da tau portano piccole modifiche in molte posizioni diverse all'interno della molecola di tau.
Anche se tali cambiamenti alla tau sono noti ai neuropatologi da decenni, non era ancora chiaro come la tau arriva in questa fase multi-modificata. Il nuovo studio ha risolto parte di questo mistero e fornisce un nuovo meccanismo per spiegare come la tau si modifica progressivamente.
Lo studio si era proposto di rispondere alla domanda se una modifica in un punto specifico della tau rende più facile il cambiamento in un altro punto. Il team si è concentrato sulla relazione tra la tau e le chinasi proteiche, enzimi che introducono cambiamenti nella tau.
"Di solito, le chinasi proteiche puntano punti specifici, chiamati siti di fosforilazione, nella tau e in altre proteine, e introducono cambiamenti solo in questi punti specifici", afferma la prima autrice dello studio dott.ssa Kristie Stefanoska, ricercatrice di demenza della Flinders University. "Tuttavia, sospettavamo che alcuni di questi enzimi fossero in grado di puntare punti diversi nella tau e lo avrebbero fatto in modo ancora più efficiente se la tau fosse già stata modificata in precedenza in un punto".
I ricercatori hanno condotto un grande esperimento che includeva fino a 20 diversi cambiamenti nella tau e in 12 enzimi, concentrandosi sul tipo più abbondante di cambiamento osservato nella tau nel cervello dei pazienti di MA
Oltre a scoprire che un cambiamento nella tau rende più facile l'introduzione di un'altra modifica, lo studio è stato anche in grado di identificare i 'siti principali' nella tau, punti specifici che regolano le modifiche successive nella maggior parte degli altri siti.
"Modificando questi siti principali, siamo riusciti a guidare la modifica in altri punti all'interno della tau, portando a uno stato simile a quello visto nel cervello dei pazienti di MA", afferma il dott. Ittner.
Il passo successivo del team è stato vedere se i siti principali potevano essere puntati per ridurre le proprietà tossiche della tau nel MA, nel tentativo di migliorare la funzione della memoria.
Lo studio ha usato topi che hanno sia amiloide che tau, e sintomi simili al MA, compresi i deficit di memoria. I ricercatori hanno scoperto che i topi non sviluppavano deficit di memoria quando avevano una versione di tau che mancava di uno dei siti principali identificati, rispetto ai topi che avevano la versione solita di Tau.
Il team ora cercherà di capire come i suoi risultati possono essere tradotti in un trattamento.
"Abbiamo dimostrato che questo nuovo concetto ha un potenziale terapeutico, ma è necessario altro lavoro per capire il ruolo di questi siti principali nella salute e nelle malattie", afferma la dott.ssa Stefanoska. "La modifica della tau nel MA è un processo complicato. Il nostro è il primo studio che collega una modifica iniziale nella tau con la modifica multi-sito lungo l'intera proteina".
Gli autori affermano che il nuovo meccanismo e i siti principali al suo centro potrebbero applicarsi a una serie di disturbi neurologici in cui è coinvolta la tau, come il morbo di Parkinson, le lesioni cerebrali croniche indotte da commozioni cerebrali e l'ictus.
"Il rallentamento dei cambiamenti nei siti principali di tau in queste malattie può frenare la tossicità della tau e la demenza", afferma il dott. Ittner. "Questo nuovo meccanismo ci aiuta a capire innanzitutto perché ci sono ampie modifiche alla tau nel MA. Ciò aiuterà i ricercatori e i clinici a progettare i modi per una diagnosi migliore e anticipata".
Fonte: Flinders University via EurekAlert! (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Kristie Stefanoska, ...[+6], Arne Ittner. Alzheimer’s disease: Ablating single master site abolishes tau hyperphosphorylation. Science Advances, 6 Jul 2022, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.








 Associazione Alzheimer OdV
Associazione Alzheimer OdV