Il morbo di Alzheimer (MA) è una condizione neurodegenerativa. Al momento non esistono terapie modificanti la malattia approvate dalla FDA per il MA, nonostante sia la causa più comune di demenza. Il MA è causato dalla morte progressiva delle cellule neuronali.
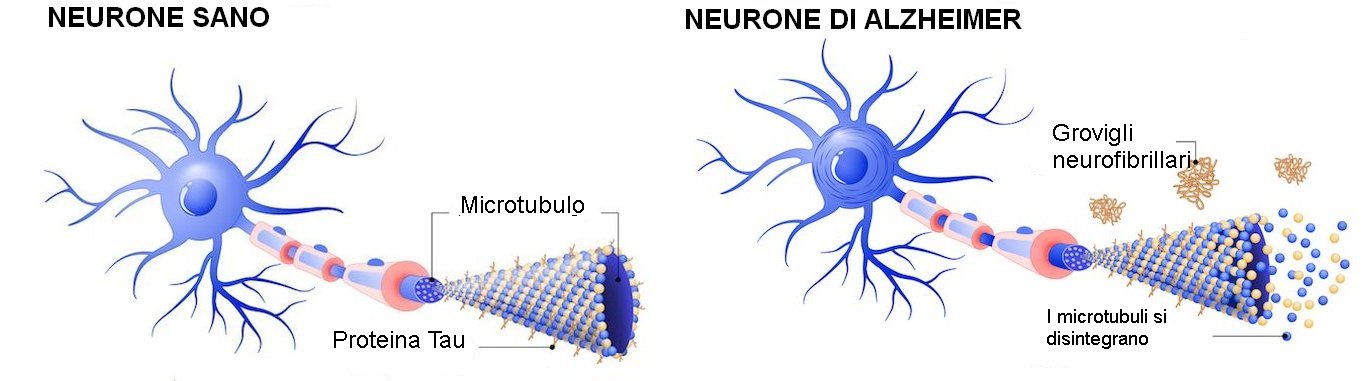
L'iperfosforilazione della proteina 'tau' può causare mal ripiegamento e aggregati che provocano la compromissione delle sinapsi e, infine, la morte neuronale osservata nei pazienti con MA. La capacità della dual‐specificity tyrosine phosphorylation‐regulated kinase‐1A (DYRK1A) di regolare direttamente e indirettamente la fosforilazione della tau, la rende un bersaglio terapeutico attraente per il MA.
Abbiamo parlato di recente con Osman Kibar, CEO di Samumed, per saperne di più sullo sviluppo del SM07883, il loro inibitore della chinasi DYRK1A a piccole molecole.
Laura Lansdowne (LL): Cos'è la Tau e cosa sappiamo del suo ruolo nel MA?
Osman Kibar (OK): La patologia Tau è un segno molecolare del MA. La Tau è una proteina multifunzionale che in condizioni normali contribuisce alla funzione sana del neurone. Tuttavia, in determinate condizioni, uno squilibrio degli enzimi nel cervello potrebbe portare all'iperfosforilazione della tau, determinando malfunzionamenti, aggregati e infine grovigli neurofibrillari (patologia tau). Sia la tau che i grovigli mal ripiegati possono portare a compromissione delle sinapsi e infine alla morte neuronale. Anche se i grovigli neurofibrillari sono stati rilevati per la prima volta nel cervello di MA oltre cento anni fa, è stato solo negli anni '80 che i ricercatori hanno iniziato a capire che i grovigli neurofibrillari erano composti da proteine tau mal ripiegate. L'interesse delle aziende farmaceutiche a prevenire l'accumulo patologico di tau è diventato solo di recente oggetto di potenziale intervento terapeutico per il MA. È significativo che l'accumulo di patologia tau nel MA è altamente correlato con il restringimento del cervello e il declino cognitivo. Ciò differisce dall'amiloide-beta, in cui la formazione della placca amiloide (un altro segno distintivo del MA) non è direttamente correlata al declino cognitivo.
LL: Qual è la relazione tra «chinasi 1A regolata dalla fosforilazione» (DYRK1A) e Tau?
OK: La «Dual‐specificity tyrosine phosphorylation‐regulated kinase‐1A» (DYRK1A) rappresenta un nuovo promettente obiettivo per un candidato farmaco di MA perché può regolare direttamente e indirettamente la fosforilazione della tau. L'analisi post mortem del cervello di MA ha mostrato una sovraespressione di DYRK1A e studi sui topi hanno dimostrato che la sovraespressione di DYRK1A porta ad un aumento della tau fosforilata. È importante sottolineare che l'iperfosforilazione di tau indotta da DYRK1A ha dimostrato di interrompere la funzione normale della tau e di promuoverne l'aggregazione.
LL: Di recente hai pubblicato una ricerca sul potenziale terapeutico del SM07883 come trattamento per il MA. Potresti dirci di più su questo farmaco a piccole molecole? Qual è il suo meccanismo d'azione?
OK: Il SM07883 è un inibitore della chinasi DYRK1A a piccole molecole. È somministrato per via orale e ha la capacità di attraversare la barriera emato-encefalica sulla base di studi sugli animali. Inibendo in modo potente e specifico la DYRK1A, il principale meccanismo d'azione è prevenire la fosforilazione di tau. Ha anche dimostrato forti effetti anti-infiammatori. Si ipotizza che anche l'infiammazione cronica nel cervello contribuisca alla progressione del MA. Infine, sebbene non sia stato incluso nel nostro studio pubblicato di recente, in precedenza abbiamo presentato dati secondo cui il SM07883 inibisce la fosforilazione della proteina precursore dell'amiloide (APP). L'APP fosforilata porta alla formazione di depositi di amiloide-beta. Speriamo di pubblicare questi dati in un futuro documento peer-reviewed (=a controllo dei pari). Nell'insieme, gli effetti benefici del SM07883 su tau, amiloide e infiammazione affrontano molteplici aspetti della patologia del MA.
LL: Potresti evidenziare i risultati chiave dello studio?
OK: Il SM07883 ha ridotto la fosforilazione della tau sia in vitro che in vivo nei cervelli di roditori. Gli effetti a lungo termine (3 mesi) del trattamento SM07883, valutati nei topi transgenici tau (JNPL3; P301L sovraespressione di mutazione della tau umana), hanno mostrato riduzioni significative dell'iperfosforilazione della tau, della tau oligomerica e aggregata e delle inclusioni tau positive rispetto al veicolo nei campioni di cervello. Topi transgenici tau trattati con SM07883 hanno avuto anche una significativa riduzione della neuroinfiammazione associata alla malattia rispetto al veicolo. Nei test comportamentali, il SM07883 ha notevolmente migliorato la funzione rispetto al veicolo. Il SM07883 è stato ben tollerato e il trattamento ha portato a un miglioramento della salute generale e all'aumento di peso.
LL: Potresti toccare le implicazioni di questa ricerca e i prossimi passi?
OK: La Samumed sta attualmente eseguendo uno studio clinico di Fase 1 per sviluppare il SM07833 come potenziale trattamento per il MA. Non esistono terapie modificanti la malattia approvate dalla FDA per il MA e, nonostante i continui tentativi e dozzine di studi clinici, la FDA non ha approvato alcun nuovo trattamento per il MA per oltre 15 anni. La DYRK1A ha dimostrato di regolare molteplici percorsi (tau, amiloide e infiammazione) che si ipotizza contribuiscano a più stadi della patogenesi del MA. L'inibizione della DYRK1A con il SM07883 può ridurre questi fattori e la patogenesi del MA.
Fonte: Laura Elizabeth Lansdowne in Technology Networks (> English text) - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
















 Associazione Alzheimer OdV
Associazione Alzheimer OdV