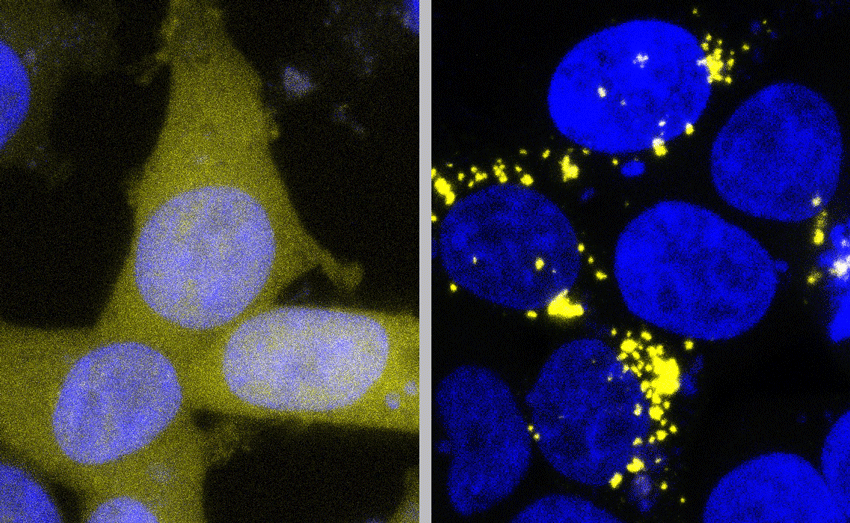
 La forma normale di Aß è contrassegnata con un marcatore giallo in queste cellule, rendendo le cellule sane un giallo pallido uniforme (a sinistra). Il contatto con le forme prioniche di Aß - ad esempio negli estratti di tessuto cerebrale umano - costringe anche queste proteine gialle a prendere la forma appiccicosa di prione, portando alla formazione di grumi gialli brillanti (a destra). Fonte: Prusiner Lab / UCSF
La forma normale di Aß è contrassegnata con un marcatore giallo in queste cellule, rendendo le cellule sane un giallo pallido uniforme (a sinistra). Il contatto con le forme prioniche di Aß - ad esempio negli estratti di tessuto cerebrale umano - costringe anche queste proteine gialle a prendere la forma appiccicosa di prione, portando alla formazione di grumi gialli brillanti (a destra). Fonte: Prusiner Lab / UCSF
Due proteine centrali nella patologia del morbo di Alzheimer (MA) agiscono come prioni - proteine deformi che si diffondono attraverso i tessuti come un'infezione, costringendo le proteine normali ad adottare la stessa forma mal ripiegata - secondo una nuova ricerca dell'Università della California di San Francisco.
Usando nuovi test di laboratorio, i ricercatori sono riusciti a rilevare e misurare forme prioniche specifiche di auto-propagazione delle proteine amiloide-beta (Aß) e tau nel tessuto cerebrale postmortem di 75 pazienti con MA. La scoperta sorprendente è stata che i livelli più alti di questi prioni nei campioni di cervello umano erano fortemente associati a forme di esordio precoce della malattia e all'età più giovane alla morte.
IL MA è attualmente definito in base alla presenza di aggregazioni di proteine tossiche nel cervello chiamate placche amiloidi e grovigli tau, accompagnate da declino cognitivo e demenza. Ma i tentativi di trattare la malattia eliminando queste proteine inerti non hanno avuto successo.
La nuova evidenza che i prioni attivi di Aß e tau potrebbero guidare la malattia - pubblicata il 1 maggio 2019 in Science Translational Medicine - potrebbe portare i ricercatori a esplorare nuove terapie che si concentrano direttamente sui prioni. Stanley Prusiner MD, autore senior dello studio e direttore dell'Istituto UCSF Malattie Neurodegenerative, che fa parte dell'UCSF Weill Institute for Neurosciences, ha detto:
"Credo che questo dimostri oltre ogni ragionevole dubbio che Aß e tau sono entrambi prioni e che il MA è un disturbo a doppio prione in cui queste due proteine canaglia distruggono insieme il cervello.
"Il fatto che i livelli dei prioni appaiano legati anche alla longevità dei pazienti dovrebbe cambiare il modo in cui pensiamo alla soluzione per sviluppare trattamenti per la malattia. Abbiamo bisogno di un cambiamento epocale nella ricerca sul MA, e questo è ciò che fa questo studio. Questa ricerca potrebbe catalizzare un cambiamento importante nella ricerca di MA".
Cosa sono i prioni?
I prioni sono versioni ripiegate in modo errato di una proteina, che può diffondersi come un'infezione costringendo le copie normali di quella proteina a prendere la stessa forma auto-propagante e mal ripiegata. La proteina prionica originale (PrP) è stata identificata da Prusiner negli anni '80 come causa della malattia di Creutzfeldt Jakob (CJD) e dell'encefalopatia bovina spongiforme, nota anche come morbo della mucca pazza, che si diffuse attraverso il consumo di carne e farina d'ossa contaminata dai prioni PrP.
Quella è stata la prima volta che una malattia ha dimostrato di infettare le persone non per l'infestazione di un organismo come un batterio o un virus, ma attraverso una proteina infettiva, e Prusiner ha ricevuto il premio Nobel per tale scoperta nel 1997.
Prusiner e colleghi stanno da tempo sospettando che la PrP non è l'unica proteina capace di agire come un prione auto-propagante, e che diversi tipi di prioni potrebbero essere responsabili di altre malattie neurodegenerative causate dal progressivo accumulo tossico di proteine mal ripiegate. Ad esempio, il MA è definito da placche di Aß e grovigli di tau che gradualmente diffondono la distruzione nel cervello.
Negli ultimi dieci anni, studi di laboratorio all'UCSF e altrove hanno iniziato a dimostrare che le placche Aß e i grovigli tau dei cervelli malati possono infettare tessuto cerebrale sano proprio come la PrP, ma molto più lentamente. Molti scienziati sono stati riluttanti ad accettare che Aß e tau siano prioni auto-propaganti - riferendosi invece alla loro diffusione come 'di tipo prionico' - perché a differenza dei prioni PrP, non si pensava che fossero contagiosi se non in studi di laboratorio altamente controllati.
Tuttavia, rapporti recenti hanno documentato rari casi di pazienti trattati con ormone della crescita derivati dal tessuto cerebrale umano, o sottoposti a trapianti della dura mater protettiva del cervello, che in seguito hanno sviluppato placche di Aß in mezza età, molto prima che fossero visti in chiunque senza una malattia genetica. Prusiner sostiene che questi risultati sono a supporto che sia Aß che tau sono prioni anche se si propagano più lentamente dei prioni PrP altamente aggressivi.
In relazione a questo dibattito, Prusiner ama citare il neuroscienziato Bernard Katz che, in una conferenza del 1969, ha detto: "C'è un tipo di scienziato che, se ha la scelta, preferirebbe usare lo spazzolino da denti del suo collega piuttosto che la sua terminologia!"
Biosaggi di laboratorio rivelano prioni Aß e Tau nei campioni cerebrali postmortem umani
Nel nuovo studio, i ricercatori hanno combinato due test di laboratorio recentemente sviluppati per misurare rapidamente prioni in campioni di tessuti umani: un nuovo sistema di rilevamento dell'Aß sviluppato nel laboratorio Prusiner e un test di prione tau sviluppato in precedenza da Marc Diamond PhD, ex membro della facoltà UCSF e ora direttore del Centro Alzheimer e Malattie Neurodegenerative dell'UT Southwestern Medical Center.
A differenza dei precedenti modelli animali che potrebbero richiedere mesi per rivelare la lenta diffusione di prioni Aß e/o tau, questi saggi cellulari misurano i livelli di prioni infettivi in soli tre giorni, consentendo ai ricercatori di quantificare efficacemente per la prima volta i livelli di prioni sia tau che Aß in estratti elaborati da campioni di cervello post-mortem. Nel nuovo studio, hanno applicato la tecnica al tessuto cerebrale autoptico di oltre 100 individui morti con MA e altre forme di neurodegenerazione, raccolti da depositi negli Stati Uniti, in Europa e in Australia.
Nei saggi che confrontavano campioni di pazienti con MA e di persone morte di altre malattie, l'attività dei prioni corrispondeva esattamente alla patologia proteica distintiva che è stata stabilita in ciascuna malattia: in 75 cervelli del MA, era elevata l'attività sia di Aß che di tau; in 11 campioni di pazienti con angiopatia amiloide cerebrale (CAA), sono stati osservati solo prioni Aß; e in 10 campioni di degenerazione lobare frontotemporale lagata alla tau (FTLD), sono stati rilevati solo prioni tau.
Un altro saggio biologico recentemente sviluppato per i prioni alfa-sinucleina ha trovato queste particelle infettive solo nei sette campioni di pazienti con disordine degenerativo 'atrofia del sistema multipla' legata alla sinucleina (MSA, multiple system atrophy).
William DeGrado PhD, professore di chimica farmaceutica, coautore, chimico delle proteine e membro dell'UCSF Cardiovascular Research Institute, che ha contribuito alla progettazione e all'analisi del presente studio, ha detto:
"Questi test sono un punto di svolta. In precedenza la ricerca sul MA si è bloccata sull'analisi dei danni collaterali sotto forma di proteine morte e mal ripiegate che formano placche e grovigli. Ora si scopre che è l'attività prionica che si correla con la malattia, piuttosto che la quantità di placche e grovigli al momento dell'autopsia.
"Quindi, per sviluppare terapie e diagnostiche efficaci, dobbiamo puntare le forme di prioni, piuttosto che la grande quantità di proteine nelle placche e nei grovigli".
Attività prionica di Aß e Tau legate alla longevità dei malati di MA
La scoperta più notevole del nuovo studio potrebbe essere che le forme di prioni auto-propaganti di tau e Aß sono più contagiose nel cervello dei malati di MA morti in giovane età a causa di forme ereditarie e geneticamente guidate della malattia, ma molto meno prevalenti nei pazienti deceduti in età avanzata.
In particolare, nel confronto delle misurazioni dell'accumulo globale di tau - che è noto aumentare con l'età nel cervello di MA - i ricercatori hanno riscontrato un declino esponenziale notevole dell'abbondanza relativa delle forme prioniche di tau con l'età. Quando i ricercatori hanno tracciato i loro dati, hanno visto una correlazione estremamente forte tra i prioni tau e l'età dei pazienti alla morte: rispetto ai livelli globali di tau, la quantità di prioni tau nel cervello di un paziente morto a 40 anni era in media 32 volte più alto che in un paziente morto a 90 anni.
"Ricordo ancora dove ero seduto e che ora era quando ho visto questi dati più di un anno fa", ha detto il co-autore e ricercatore di neurodegenerazione William Seeley MD, professore di neurologia, direttore dell'UCSF Neurodegenerative Disease Brain Bank, che ha fornito il tessuto cerebrale usato nello studio. "Ho visto raramente, se non mai, questo tipo di correlazione nei dati biologici umani. Ora il lavoro è scoprire cosa implica la correlazione".
La ricerca solleva una serie di domande che dovranno essere affrontate da studi futuri, incluso se le differenze nell'infettività da prioni potrebbero spiegare il mistero di vecchia data del perché il MA progredisce a tassi così diversi in pazienti diversi. Altre domande aperte risultanti dalla ricerca includono se livelli più alti di prioni nei campioni cerebrali di pazienti più giovani sono legati all'esordio precoce della malattia o quanto rapidamente progredisce, e se i livelli di prione più bassi nei cervelli più anziani riflettono meno varianti 'infettive' di prioni o una certa capacità del cervello di questi pazienti di smaltire proteine mal ripiegate.
L'evidenza che le forme prioniche di Aß e tau hanno un ruolo specifico nel MA - che non può essere catturata semplicemente contando placche amiloidi e grovigli di tau nel cervello del paziente - solleva anche domande sugli attuali approcci alla diagnosi di MA, alla progettazione clinica e alla scoperta di farmaci, affermano gli autori, che sperano che i loro nuovi esperimenti stimolino un rinnovato interesse nello sviluppo di terapie mirate alle proteine prioniche ora misurabili.
"Abbiamo visto di recente che molte terapie del MA apparentemente promettenti falliscono negli studi clinici, portando alcuni a ipotizzare che abbiamo preso di mira le proteine sbagliate", ha detto Carlo Condello PhD, uno degli autori dello studio. "E se invece non avessimo progettato farmaci contro le forme specifiche dei prioni di queste proteine che effettivamente causano la malattia? Ora che possiamo misurare efficacemente le forme di prione di Aß e tau, c'è la speranza di riuscire a sviluppare farmaci che impediscono loro di formarsi o diffondersi, o che aiutano il cervello a eliminarli prima che causino danni".
Fonte: Nicholas Weiler in UC San Francisco (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Atsushi Aoyagi, Carlo Condello, Jan Stöhr, Weizhou Yue, Brianna M. Rivera, Joanne C. Lee, Amanda L. Woerman, Glenda Halliday, Sjoerd Van Duinen, Martin Ingelsson, Lars Lannfelt, Caroline Graff, Thomas D. Bird, C. Dirk Keene, William W. Seeley, William F. Degrado, and Stanley B. Prusiner. Aβ and tau prion-like activities decline with longevity in the Alzheimer’s disease human brain. Science Translational Medicine, 1 May 2019, DOI: 10.1126/scitranslmed.aat8462
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.











 Associazione Alzheimer OdV
Associazione Alzheimer OdV