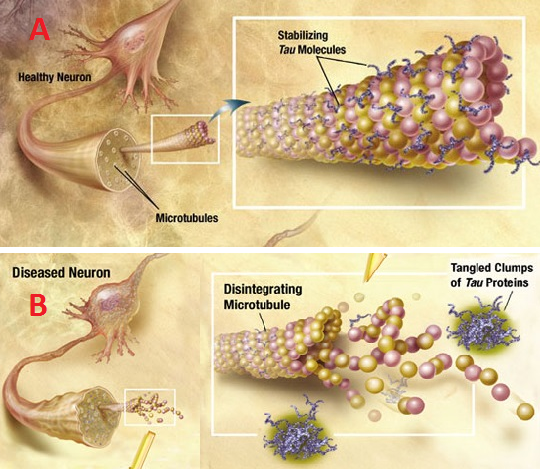
 In alto l'assone di un neurone sano con i microtubuli intatti stabilizzati dalla tau sana. In basso l'assone di un neurone malato con i microtubuli distrutti dai grovigli di proteina Tau fosforilata.Ricercatori del Massachusetts General Hospital (MGH) hanno scoperto un meccanismo che sta dietro alla diffusione dei grovigli neurofibrillari (una delle due caratteristiche dell'Alzheimer) nel cervello delle persone colpite.
In alto l'assone di un neurone sano con i microtubuli intatti stabilizzati dalla tau sana. In basso l'assone di un neurone malato con i microtubuli distrutti dai grovigli di proteina Tau fosforilata.Ricercatori del Massachusetts General Hospital (MGH) hanno scoperto un meccanismo che sta dietro alla diffusione dei grovigli neurofibrillari (una delle due caratteristiche dell'Alzheimer) nel cervello delle persone colpite.
In un rapporto che è stato pubblicato online sulla rivista Nature Communications, il team di ricerca descrive la scoperta che una particolare versione della proteina tau, pur estremamente rara nel cervello dei pazienti con Alzheimer, è in grado di diffondersi da un neurone all'altro e come avviene questo processo.
"Si è ipotizzato che i grovigli (l'accumulo anomalo di proteina tau che riempie i neuroni nell'Alzheimer) possono viaggiare da un neurone all'altro con la progressione della malattia, diffondendo di pari passo le disfunzioni nel cervello. Ma come ciò avvenga era finora incerto", afferma Bradley Hyman MD/PhD, direttore dell'Alzheimer’s Disease Research Center del MGH e autore senior della relazione. "Il nostro attuale studio suggerisce che uno dei meccanismi in atto dipende dalle proprietà che stavamo cercando di un tipo unico e raro di tau: esso viene rilasciato dai neuroni, ripreso da altri neuroni, trasportato su e giù per gli assoni, e poi rilasciato di nuovo".
Ricerche precedenti avevano dimostrato che i grovigli tau appaiono inizialmente in una struttura situata in profondità all'interno del cervello, chiamata corteccia entorinale, che è un centro dei segnali che passano tra l'ippocampo e la corteccia cerebrale.
I grovigli appaiono in seguito in altre strutture vicine coinvolte con la memoria e la cognizione, ma non era chiaro se tale progressione riflette il movimento delle proteine tau attraverso i neuroni adiacenti o qualche altro processo.
Diversi studi dal 2013 del gruppo di Hyman e di altri hanno mostrato il movimento di una forma mutante di tau tra le strutture cerebrali e la conseguente neurodegenerazione in un modello di topo. Una delle ricerche di Hyman aveva anche suggerito che il processo potrebbe essere interrotto, ma non era ancora stato dimostrato esattamente come avviene il trasporto da una cellula all'altra.
L'attuale studio ha rivelato che, quando vengono applicati neuroni in coltura a un campione del cervello di quel modello di topo, soltanto l'1 per cento della tau in tali campioni è ripreso dai neuroni. Le proteine tau che sono state riprese erano solubili con un alto peso molecolare (che significa che un certo numero di proteine più piccole sono legate insieme in una molecola più grande), e fissate con un grande numero di molecole di fosfato, una caratteristica nota della tau nei grovigli associati all'Alzheimer.
Risultati simili sono stati osservati in esperimenti su campioni di cervello di malati di Alzheimer, sia in neuroni di coltura che in topi vivi. Il processo mediante cui la versione di tau passa tra i neuroni è stata illustrata con un dispositivo microfluidico sviluppato al MGH BioMEMS Resource Center.
Il dispositivo consiste di tre camere, le primi due contenenti neuroni di topo, collegati da microsolchi attraverso cui possono estendersi gli assoni (le fibre che trasportano segnali da un neurone all'altro). Il team ha scoperto che l'applicazione di questa rara forma di tau dal cervello del modello di topo ai neuroni nella prima camera ha portato i neuroni ad acquisire la proteina, entro cinque giorni, essendo presenti alle estremità dei assoni della prima-camera-neuroni e nei neuroni nella seconda camera.
Alcuni giorni dopo, la tau è stata rilevata alla fine degli assoni che si estendevano dalla seconda alla terza camera, che conteneva neuroni. La rimozione della tau dalla prima camera non l'ha fatta scomparire dalla seconda camera, fatto che indica che una volta che una certa quantità della versione patologica della proteina è stato ripresa, i neuroni possono continuare a farla transitare anche dopo che viene a mancare la fonte originale.
Ulteriori esperimenti con la tau del cervello dei malati di Alzheimer hanno confermato che la versione solubile, ad alto peso molecolare, con fosfato, è ripresa e passata tra i neuroni.
"I nostri risultati suggeriscono che il rilascio e la diffusione di questa forma di tau è un passo importante nella diffusione della malattia da una regione del cervello ad un'altra", dice Hyman, professore Ordinario di Neurologia alla Harvard Medical School. "Dal momento che questa diffusione è probabilmente alla base della progressione clinica dei sintomi, puntare i meccanismi di diffusione potrebbe essere un metodo promettente per stabilizzare la malattia".
Fonte: Massachusetts General Hospital (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Shuko Takeda, Susanne Wegmann, Hansang Cho, Sarah L. DeVos, Caitlin Commins, Allyson D. Roe, Samantha B. Nicholls, George A. Carlson, Rose Pitstick, Chloe K. Nobuhara, Isabel Costantino, Matthew P. Frosch, Daniel J. Müller, Daniel Irimia & Bradley T. Hyman. Neuronal uptake and propagation of a rare phosphorylated high-molecular-weight tau derived from Alzheimer’s disease brain. Nature Communications, 6, Article number: 8490. doi: 10.1038/ncomms9490
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
















 Associazione Alzheimer OdV
Associazione Alzheimer OdV