Sempre più dati provenienti da studi preclinici e clinici rafforzano l'ipotesi che le azioni mediate dal sistema immunitario contribuiscono e guidano la patogenesi dell'Alzheimer.
Il team di Roosmarijn Vandenbroucke nel Claude Libert Group (VIB/UGent) ha unito le sue conoscenze e competenze relative all'infiammazione, con l'esperienza sull'Alzheimer acquisita dal Bart De Strooper Group (VIB/KU Leuven).
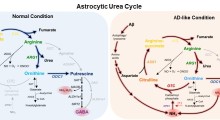
Questo collaborazione ha portato all'intuizione che l'amiloide-beta (Aβ) induce realmente una risposta infiammatoria forte, distruggendo in tal modo un barriera cerebrale importante ma spesso trascurata, la barriera emato-fluido cerebrospinale (CSF).
La distruzione di questa barriera emato-CSF disturba l'omeostasi del cervello e potrebbe influire negativamente sulla progressione della malattia. E' importante notare che questi effetti potrebbero essere bloccati dalla presenza di un inibitore dei metalloproteinasi della matrice (MMP).
Roosmarijn Vandenbroucke dice: "Anche se sono necessarie ulteriori ricerche, questi dati suggeriscono che bloccare l'attività degli MMP o della segnalazione infiammatoria a monte, potrebbe avere un potenziale terapeutico per il trattamento dell'Alzheimer. E' importante che abbiamo potuto dimostrare il ruolo della barriera emato-fluido cerebrospinale, perché questo sarebbe un obiettivo più facile da raggiungere rispetto a quelli delle terapie attuali".
La pubblicazione di Vandenbroucke et al. è stata ripresa da Alzforum.org che l'ha combinata con un'altra pubblicazione sulla barriera emato-encefalica, la cui traduzione è disponibile qui di seguito.
Barriere tra sangue e CSF nel cervello producono Aβ: è una cosa così negativa?
18 settembre, 2015
Nell'Alzheimer si sgretola la barriera tra il sangue e il sistema nervoso centrale, ma i ricercatori sanno poco su come accade ciò, o cosa provoca alla patologia cerebrale.
Due nuovi documenti gettano luce sul modo in cui l'Aβ danneggia le cellule che proteggono il parenchima cerebrale e il liquido cerebrospinale. Gli studi esaminano i diversi sistemi e descrivono meccanismi distinti, ma entrambi spiegano meglio il quadro di ciò che può accadere nella malattia.
In uno studio apparso il 18 Settembre su Science Advances, i ricercatori guidati da Matthew Campbell del Trinity College di Dublino riferiscono che i monomeri Aβ40 aprono piccole lacune nella barriera emato-encefalica, permettendo ai peptidi di insinuarsi tra le cellule endoteliali ed entrare nel flusso sanguigno.
Questo percorso di eliminazione non era stato sospettato in precedenza, e può aiutare il cervello ad eliminare alte concentrazioni di Aβ, ha suggerito Campbell. In linea con questo, egli ha scoperto che indebolire transitoriamente l'integrità della barriera emato-encefalica in modelli di topo con accumulo di amiloide, accresce l'eliminazione dell'Aβ, abbassa il carico di amiloide nel cervello, e migliora la cognizione, suggerendo che questo meccanismo potrebbe essere sfruttato terapeuticamente. Campbell e colleghi stanno testando questa idea nei primati.
Al contrario, ricercatori guidati da Roosmarijn Vandenbroucke dell'Università di Gand in Belgio, si sono concentrati sugli effetti nocivi dell'Aβ sul plesso epitelio coroide, una membrana che fodera i ventricoli cerebrali e separa i vasi sanguigni dal liquido cerebrospinale (CSF).
Il 16 Settembre sul Journal of Neuroscience i ricercatori hanno riferito che alti livelli di oligomeri Aβ42 sintetici danneggiano questa barriera in poche ore, interrompendo le giunzioni strette tra le cellule epiteliali e distorcendo la forma delle cellule. Gli scienziati hanno rintracciato la causa nei fattori infiammatori sovra-regolati e nei metalloproteinasi della matrice (MMP). Gli MMP sono enzimi che ingoiano le proteine, comprese quelle delle giunzioni strette. L'inibizione dei MMP impedisce i danneggiamenti.
Costantino Iadecola del Weill Cornell Medical College di New York, ha lodato gli autori per aver messo a fuoco una zona che riceve poco studio. "Non sappiamo abbastanza sulla barriera emato-encefalica e su quella emato-CSF. Questi documenti affrontano questioni interessanti che dovrebbero migliorare la nostra comprensione degli effetti dell'Aβ su queste strutture", ha detto ad Alzforum.
Le barriera emato-encefalica si forma nei capillari, dove le proteine come la claudina-5 e l'occludina si legano creando giunzioni strette tra le cellule endoteliali che compongono il vaso capillare. Le giunzioni impediscono alle molecole di scivolare tra le cellule, bloccando così il passaggio di soluti all'interno o all'esterno del cervello.
Questa barriera aiuta a mantenere l'omeostasi nel cervello, ma complica anche l'eliminazione dei detriti, compresa l'Aβ. Parte dell'Aβ può attraversare la barriera emato-encefalica tramite un trasporto attivo attraverso le cellule endoteliali (vedi Deane et al., 2003; Deane et al., 2004). Dall'altra parte, non è ancora chiaro se l'Aβ può anche filtrare attraverso le giunzioni strette tra le cellule endoteliali, il cosiddetto sentiero 'paracellulare'. Si è scoperto curiosamente che l'Aβ sopprime le proteine della giunzione stretta (vedi Notizie Sett 2011; Carrano et al., 2011; Hartz et al., 2012).
Confermando questi ultimi risultati, il primo autore James Keaney del gruppo di Campbell ha dimostrato che l'aggiunta di monomeri Aβ40 sintetici e dimeri sopprime transitoriamente la claudina-5 e l'occludina in colture cellulari endoteliali. Allo stesso modo, nei topi che sovra-esprimono la proteina precursore dell'amiloide, gli autori hanno visto poche claudina-5 e occludina lungo porzioni di capillari ostruiti con amiloide.
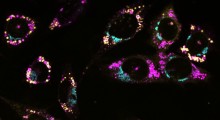
Anche le sezioni di cervello post-mortem provenienti da 30 pazienti di Alzheimer e da controlli hanno mostrato meno claudina-5 e occludina nei vasi sanguigni ingombri di amiloide, ma una quantità normale nelle sezioni dei vasi sani a pochi micron di distanza (vedi immagine sotto).
Il calo di queste proteine di giunzione stretta potrebbe permettere all'Aβ40 di scivolare fuori del cervello? Gli autori hanno usato siRNA per sopprimere la traduzione di claudina-5 e occludina in colture di cellule endoteliali che mantengono le giunzioni strette e formano un monostrato che separa due gruppi di elementi.
In questo modello cellulare della barriera emato-encefalica gli autori hanno trovato che i monomeri Aβ40, ma non i dimeri, passano attraverso la barriera indebolita. Ciò ha suggerito che le lacune sono abbastanza grandi per far passare solo molecole di dimensioni inferiori a 8 kDa. La soppressione delle stesse proteine di giunzione stretta nei topi normali ha permesso a molecole di 3 kDa, ma non di 10 kDa, di diffondersi dal cervello al sangue.
Gli autori si sono chiesti quale effetto potrebbe avere questa permeabilità nel contesto di un eccesso di amiloide. Hanno soppresso l'espressione di claudina-5 e di occludina una volta ogni tre settimane per nove mesi nei topi, causando un rilassamento sporadico e transitorio della barriera emato-encefalica. I livelli plasmatici di Aβ40 solubile sono saltati in alto di circa tre volte (fatto positivo), mentre i livelli cerebrali sono caduti della metà (altro fatto positivo). Gli animali trattati hanno ottenuto risultati migliori in un labirinto a T, che misura la memoria spaziale. L'autore dice che questa scoperta suggerisce un potenziale terapeutico.
Campbell sta indagando se sopprimere queste proteine di giunzione stretta nei topi, appena prima di somministrare un anticorpo anti-amiloide, potrebbe aumentare l'eliminazione dell'Aβ dal cervello. Egli ha osservato che finora la soppressione transitoria di proteine di giunzione stretta via siRNA appare sicura sia nei topi che nelle scimmie, senza segni di edema cerebrale che sappiamo accompagna la rottura della barriera emato-encefalica. Egli crede che questo sia perché la barriera si apre solo leggermente, per un breve periodo. "Stiamo portando via solo una piccola quantità di materiale giunzionale per rendere la barriera marginalmente permeabile", ha spiegato Campbell.
Altri concordano che la scoperta è promettente. "I dati indicano che si può modulare l'assorbimento di Aβ nel sangue, e che a sua volta abbassa l'amiloide cerebrale e ritarda il declino cognitivo. Questo è qualcosa che vale la pena di esaminare", ha osservato Roy Weller dell'Università di Southampton (GB). Tuttavia, i ricercatori hanno avvertito che si dovrebbero esaminare attentamente gli effetti collaterali, per garantire che molecole tossiche non entrino nel cervello attraverso la barriera indebolita.
La Vandenbroucke ha definito affascinante la ricerca, anche se si è chiesta come la soppressione sistematica di proteine di giunzione stretta possa influenzare la barriera emato-CSF. Le molecole che passano attraverso questo confine diverso, acquisiscono un accesso diretto al CSF e al liquido interstiziale del cervello, a differenza delle molecole che sgusciano attraverso la barriera emato-encefalica, dove altri tipi di cellule, come i periciti e gli astrociti, danno un ulteriore livello di protezione al parenchima cerebrale. Quindi la barriera emato-CSF potrebbe essere più vulnerabile (rispetto alla barriera emato-encefalica) agli effetti dannosi della permeabilità transitoria, ipotizza la Vandenbroucke.
La barriera tra sangue e CSF ha ricevuto molta meno attenzione di quella emato-encefalica, anche se alcuni studi sostengono che questo confine scema nel cervello di AD (vedi Serot et al., 2000; Krzyzanowska e Carro 2012). Per indagare, i primi co-autori Marjana Brkic e Sriram Balusu del gruppo della Vandenbroucke hanno iniettato oligomeri Aβ42 sintetici nei ventricoli cerebrali di topi normali.
Dopo 2 e 6 ore, hanno visto una spinta enorme nell'espressione di citochine infiammatorie IL-6, IL1β, e TNF-α, nel plesso coroideo. Questo è stato accompagnato da un aumento dell'espressione e dell'attività di diversi MMP, in particolare MMP3, saliti vertiginosamente di 15 volte. Allo stesso tempo, le cellule epiteliali del plesso coroideo si sono ridotte, perdendo la loro forma grassoccia e cuboidale. L'espressione di claudina-5 e occludina è scesa alla metà, e la barriera emato-CSF ha iniziato a perdere.
Gli MMP sono stati implicati in precedenza nella distruzione della barriera emato-CSF (vedi Zeni et al., 2007; Batra et al., 2010; Vandenbroucke et al., 2012). Brkic e colleghi si sono chiesti se questi enzimi, che sono attivati dall'infiammazione, potrebbero ingoiare la barriera. A supporto di ciò, la co-iniezione di un inibitore dei MMP ad ampio spettro, assieme all'Aβ42, ha prevenuto danni alla barriera. Allo stesso modo, topi senza MMP3 ai quali erano stati iniettati oligomeri Aβ42, hanno sviluppati solo una leggera perdita rispetto alle controparti normali iniettate.
Questi esperimenti evidenziano gli effetti acuti dell'Aβ, ma cosa accade a lungo termine? Nel lavoro in atto, gli autori stanno esaminando la barriera emato-CSF per giorni e settimane dopo l'iniezione di Aβ. Essi stanno anche studiando questa barriera nei topi che sovra-producono Aβ. Nel lavoro preliminare, questi animali sembrano sviluppare spontaneamente qualche perdita tra CSF e sangue, anche se meno pronunciata che nei topi iniettati, ha detto la Vandenbroucke ad Alzforum, aggiungendo che questo potrebbe significare che, in condizioni croniche di Aβ alta, le giunzioni strette possono stabilizzarsi in una certa misura.
Inoltre, la Vandenbroucke valuterà se inibire gli MMP migliora la cognizione nei topi. Tali dati potrebbero consigliare di sopprimere terapeuticamente questi enzimi. Gli inibitori MMP ad ampio spettro sono stati testati in studi clinici per il cancro, ma hanno causato effetti collaterali come dolori muscolari, e non sono un'opzione, ha osservato la Vandenbroucke. Le alternative sarebbero puntare degli MMP3 specifici, o di sopprimere i fattori infiammatori a monte che aumentano la sua espressione. Sappiamo che il cervello dei malati di Alzheimer contiene livelli elevati di metalloproteinasi (vedi Wang et al., 2014).
Berislav Zlokovic della University of Southern California di Los Angeles, ha trovato i dati intriganti. "Questo studio è innovativo nel mettere in luce l'impatto negativo degli oligomeri Aβ1-42 al BCSFB e la potenziale capacità degli MMP, in particolare MMP-3, di mediare questo effetto. Gli MMP sembrano essere di importanza cruciale nel regolare l'integrità delle barriere vascolari specializzate del cervello, comprese sia la barriera emato-encefalica che quella emato-CSF", ha scritto ad Alzforum.
Madolyn Bowman Rogers
Citazioni
- Deane R, Du Yan S, Submamaryan RK, LaRue B, Jovanovic S, Hogg E, Welch D, Manness L, Lin C, Yu J, Zhu H, Ghiso J, Frangione B, Stern A, Schmidt AM, Armstrong DL, Arnold B, Liliensiek B, Nawroth P, Hofman F, Kindy M, Stern D, Zlokovic B. RAGE mediates amyloid-beta peptide transport across the blood-brain barrier and accumulation in brain. Nat Med. 2003 Jul;9(7):907-13. PubMed.
- Deane R, Wu Z, Sagare A, Davis J, Du Yan S, Hamm K, Xu F, Parisi M, LaRue B, Hu HW, Spijkers P, Guo H, Song X, Lenting PJ, Van Nostrand WE, Zlokovic BV. LRP/amyloid beta-peptide interaction mediates differential brain efflux of Abeta isoforms. Neuron. 2004 Aug 5;43(3):333-44. PubMed.
- Carrano A, Hoozemans JJ, van der Vies SM, Rozemuller AJ, van Horssen J, de Vries HE. Amyloid Beta induces oxidative stress-mediated blood-brain barrier changes in capillary amyloid angiopathy. Antioxid Redox Signal. 2011 Sep 1;15(5):1167-78. PubMed.
- Hartz AM, Bauer B, Soldner EL, Wolf A, Boy S, Backhaus R, Mihaljevic I, Bogdahn U, Klünemann HH, Schuierer G, Schlachetzki F. Amyloid-β Contributes to Blood-Brain Barrier Leakage in Transgenic Human Amyloid Precursor Protein Mice and in Humans With Cerebral Amyloid Angiopathy. Stroke. 2012 Feb;43(2):514-23. PubMed.
- Serot JM, Béné MC, Foliguet B, Faure GC. Morphological alterations of the choroid plexus in late-onset Alzheimer's disease. Acta Neuropathol. 2000 Feb;99(2):105-8. PubMed.
- Krzyzanowska A, Carro E. Pathological alteration in the choroid plexus of Alzheimer's disease: implication for new therapy approaches. Front Pharmacol. 2012;3:75. Epub 2012 May 3 PubMed.
- Zeni P, Doepker E, Schulze-Topphoff U, Schulze Topphoff U, Huewel S, Tenenbaum T, Galla HJ. MMPs contribute to TNF-alpha-induced alteration of the blood-cerebrospinal fluid barrier in vitro. Am J Physiol Cell Physiol. 2007 Sep;293(3):C855-64. Epub 2007 May 16 PubMed.
- Batra A, Latour LL, Ruetzler CA, Hallenbeck JM, Spatz M, Warach S, Henning EC. Increased plasma and tissue MMP levels are associated with BCSFB and BBB disruption evident on post-contrast FLAIR after experimental stroke. J Cereb Blood Flow Metab. 2010 Jun;30(6):1188-99. Epub 2010 Mar 3 PubMed.
- Vandenbroucke RE, Dejonckheere E, Van Lint P, Demeestere D, Van Wonterghem E, Vanlaere I, Puimège L, Van Hauwermeiren F, De Rycke R, Mc Guire C, Campestre C, López-Otin C, Matthys P, Leclercq G, Libert C. Matrix metalloprotease 8-dependent extracellular matrix cleavage at the blood-CSF barrier contributes to lethality during systemic inflammatory diseases. J Neurosci. 2012 Jul 18;32(29):9805-16. PubMed.
- Wang XX, Tan MS, Yu JT, Tan L. Matrix metalloproteinases and their multiple roles in Alzheimer's disease. Biomed Res Int. 2014;2014:908636. Epub 2014 Jun 24 PubMed.
Fonte:
- VIB - Flanders Interuniversity Institute for Biotechnology (> English text) - Traduzione di Franco Pellizzari.
- Alzforum.org (> English text) - Traduzione di Franco Pellizzari.
Riferimenti:
- Marjana Brkic, Sriram Balusu, Elien Van Wonterghem, Nina Gorlé, Iryna Benilova, Anna Kremer, Inge Van Hove, Lieve Moons, Bart De Strooper, Selma Kanazir, Claude Libert, and Roosmarijn E. Vandenbroucke. Amyloid β Oligomers Disrupt Blood-CSF Barrier Integrity by Activating Matrix Metalloproteinases.J Neurosci. 2015 Sep 16;35(37):12766-78. doi:10.1523/JNEUROSCI.0006-15.2015
- James Keaney, Dominic M. Walsh, Tiernan O’Malley, Natalie Hudson, Darragh E. Crosbie, Teresa Loftus, Florike Sheehan, Jacqueline McDaid, Marian M. Humphries, John J. Callanan, Francesca M. Brett, Michael A. Farrell, Peter Humphries, Matthew Campbell. Autoregulated paracellular clearance of amyloid-beta across the blood-brain barrier.Sci Adv. 2015 Sep 18. DOI: 10.1126/sciadv.1500472
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.






 Associazione Alzheimer OdV
Associazione Alzheimer OdV