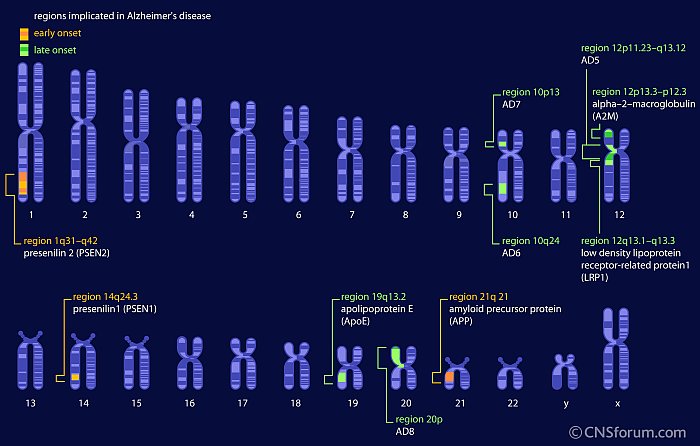
 Le regioni dei cromosomi implicate nell'Alzheimer; in arancio quelle della forma ereditaria (Fonte: CNS Forum / Lundbeck Institute)
Le regioni dei cromosomi implicate nell'Alzheimer; in arancio quelle della forma ereditaria (Fonte: CNS Forum / Lundbeck Institute)
Uno studio condotto da ricercatori del Massachusetts General Hospital (MGH) e del Brigham and Women Hospital (BWH) rivela per la prima volta esattamente come le mutazioni associate alla forma ereditaria più comune dell'Alzheimer producono gli effetti devastanti della patologia.
La ricerca, pubblicata il 4 marzo su Neuron, rovescia l'opinione convenzionale sugli effetti delle mutazioni dei geni presenilina associate all'Alzheimer e fornisce una spiegazione del fallimento dei farmaci progettati per bloccare l'attività della presenilina.
"Il nostro studio fornisce nuove informazioni sull'Alzheimer, mostrando come le mutazioni umane che causano la malattia portino alla neurodegenerazione e alla demenza", spiega Raymond J. Kelleher III, MD, PhD, del Dipartimento di Neurologia del MGH e del Center for Human Genetic Research, co-autore senior della ricerca. "Abbiamo scoperto che mutazioni nel gene presenilina-1 promuovono le impronte caratteristiche della malattia, diminuendo, piuttosto che aumentare, le funzioni della proteina presenilina-1 e dell'enzima gamma-secretasi. Oltre alle importanti implicazioni terapeutiche dei nostri risultati, abbiamo anche generato il primo modello animale in cui una mutazione che causa l'Alzheimer produce la neurodegenerazione nella corteccia cerebrale".
Anche se l'Alzheimer ereditario o famigliare (FAD) è molto raro, rappresentando solo circa l'1% dei casi, [ndt: altre fonti dicono il 5%] l'identificazione, avvenuta più di 20 anni fa dei geni che lo causano, ha fornito i primi indizi sul meccanismo che sta dietro gli effetti della malattia.
Le mutazioni più rare associate al FAD si trovano nella «proteina precursore dell'amiloide» (APP), che viene tagliata da diverse proteasi per produrre i peptidi amiloide-beta che si accumulano nelle caratteristiche placche amiloidi della malattia. Le mutazioni nei due geni presenilina, che codificano componenti essenziali della gamma secretasi (una delle proteasi che scindono l'APP), rappresentano circa il 90 per cento dei casi di FAD. Gli individui con FAD associata alla presenilina sviluppano sintomi di Alzheimer anche prima di quanto non facciano quelli con mutazioni APP.
Anche se non conosciamo il meccanismo con cui le mutazioni della presenilina causano la neurodegenerazione, l'opinione generale era che esse aumentassero la presenilina e l'attività della gamma secretasi, con la conseguente sovrapproduzione di amiloide-beta e in particolare di amiloide-beta 42, che è ritenuta più incline alla deposizione in placche. Come risultato, c'è stato un grande sforzo terapeutico per sviluppare inibitori della gamma secretasi, da parte di aziende farmaceutiche.
Ma Jie Shen, PhD, dell'Ann Romney Center for Neurologic Diseases al BWH (co-autrice senior della ricerca su Neuron), ha messo in discussione questa visione ampiamente condivisa e l'uso di inibitori di gamma secretasi per il trattamento dell'Alzheimer. Questo perché le sue precedenti indagini sulla normale funzione dei geni presenilina avevano dimostrato che sopprimere geneticamente la presenilina e l'attività della gamma secretasi in topi adulti causa una neurodegenerazione di tipo Alzheimer, risultati che contrastavano con quelli degli studi in cui la sovrapproduzione di amiloide-beta o di preseniline non producevano neurodegenerazione.
In un articolo del 2007 pubblicato su PNAS, la Shen e Kelleher (che stavano curando pazienti di FAD con mutazioni nel gene presenilina-1 e facendo ricerche sui meccanismi cerebrali sottostanti le funzioni cognitive) hanno proposto quello che hanno definito l'ipotesi presenilina, in base alla quale una perdita di funzione della presenilina può essere l'evento primario scatenante la neurodegenerazione e la demenza nel FAD.
In studi recenti, Kelleher ha identificato una nuova mutazione della presenilina-1 che causa FAD, che disattiva la sua funzione in un sistema di coltura cellulare sensibile. In collaborazione con la Shen, il suo gruppo ha continuato a dimostrare che tutta una serie di mutazioni FAD compromettono la funzione della presenilina-1 in colture cellulari.
Questi risultati hanno sollevato la questione cruciale di come tali mutazioni danneggino la funzione della presenilina-1 negli animali viventi, in particolare nel cervello. Anche se precedenti studi di Shen avevano usato ceppi di topi in cui una o più copie dei geni presenilina erano totalmente inattivi, per questo studio lei e Kelleher hanno generato topi in cui specifiche mutazioni della presenilina-1 associate al FAD erano "conficcate" ["knocked in"] nel gene, inducendole ad esprimersi come nei pazienti umani con quella particolare mutazione.
Una delle mutazioni che hanno testato è relativamente comune tra i pazienti di FAD, mentre l'altra è abbastanza rara; ed entrambe sono situate vicino al luogo dove la proteina interagisce con le sue molecole bersaglio, quando è incorporata nella gamma secretasi.
Come era nel caso degli animali in cui entrambe le copie della presenilina-1 erano state eliminate negli studi precedenti, quelli in cui sono state mutate entrambe le copie non sopravvissero dopo la nascita. I topi in cui un singolo gene presenilina-1 è stato mutato sono sopravvissuti, ma hanno mostrato più carenze dell'apprendimento e della memoria rispetto ai topi di controllo.
La produzione di amiloide-beta dentro il cervello di questi topi si è effettivamente ridotta, anche se il rapporto tra le forme del peptide è risultato modificato, con la generazione di una quantità proporzionalmente maggiore di amiloide-beta 42 associata alla placca. Un esame più attento del cervello dei topi con la mutazione FAD ha dimostrato lo stesso tipo di disfunzione sinaptica e di neurodegenerazione associata all'età presente nel cervello dei pazienti di Alzheimer.
"Questo documento dimostra chiaramente che queste mutazioni FAD causano una perdita di funzione della presenilina e dell'attività della secretasi gamma, che porta alla perdita di neuroni nel cervello adulto", spiega la Shen. "L'implicazione più importante dei nostri risultati è che dovrebbero essere studiate strategie che aumentano, piuttosto che inibire, la gamma secretasi, come potenziali terapie di Alzheimer. Essi possono anche spiegare il motivo per cui un importante studio clinico di un inibitore della gamma secretasi non è riuscito ad aiutare i pazienti e ne ha invece peggiorato le capacità cognitive".
E aggiunge che la loro ipotesi sulla presenilina non esclude un ruolo dell'amiloide-beta nella patologia di Alzheimer; mette semplicemente la presenilina e l'attività della gamma secretasi più vicino al sentiero che conduce alla neurodegenerazione.
Anche se questo studio ha esaminato solo mutazioni della presenilina-1, nota Kelleher, i ricercatori ritengono che la perdita di funzione è una proprietà generale delle mutazioni FAD in entrambi i geni presenilina. E' ampiamente giustificato anche lo studio dei meccanismi alla base degli effetti delle mutazioni APP, come lo è l'esame del modo in cui la disfunzione della presenilina può contribuire alla forma più comune di Alzheimer, quello a tarda insorgenza.
"Percorsi molecolari condivisi o convergenti possono essere responsabili della patogenesi nelle forme sia familiari che sporadiche, e speriamo che le relazioni meccanicistiche diventino più chiare con l'individuazione dei fattori di rischio genetici dell'Alzheimer sporadico o ad esordio tardivo", dice. "Stiamo perseguendo attivamente strategie per sviluppare terapie candidate che ripristinino la funzione della presenilina-1. Speriamo anche che il nostro modello di topo «knockin» possa facilitare lo sviluppo e la sperimentazione preclinica di questi e di altri agenti che possono combattere la neurodegenerazione di Alzheimer".
Fonte: Massachusetts General Hospital via EurekAlert! (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Dan Xia, Hirotaka Watanabe, Bei Wu, Sang Hun Lee, Yan Li, Evgeny Tsvetkov, Vadim Y. Bolshakov, Jie Shen, Raymond J. Kelleher. Presenilin-1 Knockin Mice Reveal Loss-of-Function Mechanism for Familial Alzheimer’s Disease. Neuron, 2015; 85 (5): 967 DOI: 10.1016/j.neuron.2015.02.010
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.











 Associazione Alzheimer OdV
Associazione Alzheimer OdV