I ricercatori del RIKEN-Max Planck Joint Research Center in Giappone hanno dimostrato che i sintomi caratteristici dell'Alzheimer possono essere ridotti quando si impedisce agli zuccheri di legarsi a uno degli enzimi chiave coinvolti nella malattia.
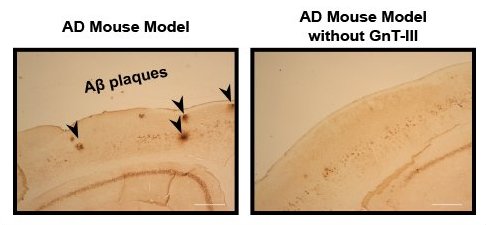 L'immunocolorazione delle placche di amiloide-beta mostra che, mentre il modello normale di topo di Alzheimer presenta numerose placche (sinistra, frecce nere), il numero di placche è significativamente ridotto quando questi topi sono privati dell'enzima GnT-III (a destra). Scala: 300 micron.
L'immunocolorazione delle placche di amiloide-beta mostra che, mentre il modello normale di topo di Alzheimer presenta numerose placche (sinistra, frecce nere), il numero di placche è significativamente ridotto quando questi topi sono privati dell'enzima GnT-III (a destra). Scala: 300 micron.
I nuovi risultati, riportati in EMBO Molecular Medicine, dimostrano che l'attaccamento anomalo di un particolare zucchero all'enzima BACE1 è un fattore critico che porta alla formazione di placche Aβ (amiloide-beta) nel cervello, e che le placche si riducono e migliorano le prestazioni cognitive quando questa azione viene impedita nei topi, attraverso la perdita dell'enzima GnT-III.
Nel farlo, questo lavoro ha rivelato un nuovo meccanismo per lo sviluppo dell'Alzheimer, aprendo potenzialmente la strada ad un nuovo approccio per il trattamento.
Un fattore importante che contribuisce all'Alzheimer è la formazione di placche patogene di Aβ nel cervello, quando l'enzima BACE1 taglia in modo anomalo la molecola APP, producendo Aβ. A causa di questo, un obiettivo centrale della ricerca di Alzheimer è lo sviluppo di farmaci che impediscano al BACE1 di fendere l'APP. Un grosso ostacolo in questi sforzi però, è trovare un modo per farlo senza disturbare altri processi vitali del cervello e del corpo che sono regolati dalla attività normale del BACE1.
Attraverso una serie di esperimenti, i ricercatori guidati da Yasuhiko Kizuka, Shinobu Kitazume e Naoyuki Taniguchi del RIKEN, in collaborazione con Tamao Endo e Shigeo Murayama del Tokyo Metropolitan Institute of Gerontology, hanno dimostrato che gran parte del BACE1 presente nel cervello di pazienti con Alzheimer è modificata dal legame di un particolare zucchero, con l'aiuto dell'enzima GnT-III.
Ipotizzando che la prevenzione di questo processo potrebbe alleviare i sintomi dell'Alzheimer, i ricercatori hanno incrociato topi che difettavano di GnT-III con altri che esprimevano APP umano nel cervello. Essi hanno scoperto che i livelli di Aβ e la formazione di placche si sono ridotti in questi topi ibridi, e che la prestazione cognitiva era migliorata.
In seguito hanno dimostrato che l'eliminazione delle versioni zuccherate di BACE1 è efficace nel prevenire la formazione della placca, perché il BACE1 senza lo zucchero viene distrutto e non può interagire con l'APP. Attraverso una procedura difficile chiamata frazionamento subcellulare, essi hanno determinato che il BACE1 zuccherato si trova vicino all'APP all'interno delle cellule. Tuttavia, se lo zucchero non è gli è attaccato, si trova più lontano dall'APP e più vicino ai lisosomi (strutture subcellulari che degradano molecole non necessarie). Quando hanno esaminato i topi senza GnT-III, hanno infatti trovato minori quantità di BACE1.
Essi hanno poi dimostrato che questo approccio è altamente selettivo. Il BACE1 di norma scinde varie proteine, diverse dall'APP, e, pur mancando delle placche Aβ, i topi privi di BACE1 soffrono anche di molti effetti collaterali e spesso non vivono più di 4 settimane. Dall'altra parte, i topi testati da Kizuka ed i suoi colleghi sono sani, fertili, e si comportano normalmente.
Quando sono stati esaminati, questi topi non hanno mostrato livelli più elevati di altre proteine che normalmente sono scisse dal BACE1, dimostrando così che puntare il GnT-III probabilmente impedisce solo al BACE1 di scindere l'APP, e che può agire per ridurre la patologia di Alzheimer, con pochi effetti collaterali potenziali.
Questa ricerca evidenzia l'importanza della glicosilazione, la modificazione di proteine da parte degli zuccheri. Lungi dall'essere raro, è il modo più comune in cui viene alterata la struttura delle proteine; oltre la metà delle proteine è glicosilata nei mammiferi.
Kizuka è entusiasta della possibilità che ora questo processo possa ottenere l'attenzione e la diffusione che merita. Egli osserva che "anche se un cambio di zucchero è spesso considerato solo un marcatore della malattia o di un tipo di cellula specifico, il nostro gruppo ha dimostrato chiaramente il ruolo funzionale di un glicano durante lo sviluppo dell'Alzheimer". E ha aggiunto che "questo lavoro offre una buona opportunità per molti ricercatori di AD di riconsiderare l'importanza della glicosilazione".
Mentre l'abbattimento del GnT-III è fattibile nei topi, un farmaco che inibisce il GnT-III nel cervello ha il potenziale di essere un trattamento efficace per ridurre la formazione di placche di Aβ e il declino cognitivo negli esseri umani. A tal fine, Kizuka e colleghi stanno usando una procedura di individuazione innovativa, in collaborazione con il RIKEN Program for Drug discovery and Medical Technology Platforms, per cercare inibitori del GnT-III.
Fonte: RIKEN (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Yasuhiko Kizuka, Shinobu Kitazume, Reiko Fujinawa, Takashi Saito, Nobuhisa Iwata, Takaomi C. Saido, Miyako Nakano,Yoshiki Yamaguchi, Yasuhiro Hashimoto, Matthias Staufenbiel, Hiroyuki Hatsuta, Shigeo Murayama, Hiroshi Manya, Tamao Endo, Naoyuki Taniguchi. An aberrant sugar modification of BACE1 blocks its lysosomal targeting in Alzheimer’s disease. EMBO Molecular Medicine, January 2015 DOI: 10.15252/emmm.201404438
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |








 Associazione Alzheimer OdV
Associazione Alzheimer OdV