Una nuova teoria sui disturbi che attaccano il cervello e la colonna vertebrale ha ricevuto un notevole impulso da scienziati della School of Medicine della Washington University di St. Louis.
La teoria attribuisce questi disturbi alle proteine che agiscono come prioni, copie di una proteina normale danneggiate in modo da causare malattie. Gli scienziati in precedenza pensavano che solo una particolare proteina avrebbe potuto essere danneggiata in questo modo, ma i ricercatori nel laboratorio di Marc Diamond, MD, riferiscono che un’altra proteina legata all'Alzheimer e a molte altre condizioni neurodegenerative si comporta proprio come un prione.
Il laboratorio di Diamond ha scoperto che la proteina tau potrebbe essere danneggiata in modi diversi, e che queste diverse forme di corruzione - chiamate ceppi - sono legate a forme distinte di danni al cervello.
“Se pensiamo a questi diversi ceppi di tau come a diversi agenti patogeni, allora possiamo cominciare a descrivere molte malattie umane legate alla tau sulla base dei ceppi che ne sono alla base”, ha detto l’autore senior Diamond, Professore «David Clayson» di Neurologia. “Questo può implicare che alcuni anticorpi o farmaci, per esempio, funzionano meglio contro alcuni disturbi rispetto ad altri”.
Lo studio è stato condotto dai primi coautori David Sanders e Sarah Kaufman, dottorandi, ed è apparso online il 22 maggio su Neuron.
I prioni sono composti da proteine normali che sono piegate in forma anomala. Essi non sono vivi, ma i loro effetti possono essere simili ai microbi infettivi come batteri o virus. La particolare struttura consente ai prioni di replicarsi attraverso una sorta di pressione tra pari molecolari: quando un prione interagisce con le proteine identiche, ma piegate normalmente, può indurre queste proteine a diventare prioni, piccoli aggregati, o grumi, che possono diffondersi da cellula a cellula.
I prioni sono balzati inizialmente all’attenzione popolare nel 1990 con la comparsa del morbo della mucca pazza, una malattia che distrugge il cervello dei bovini. Gli scienziati hanno collegato alcuni casi di una condizione simile delle persone al consumo di carne proveniente da mucche infettate. I ricercatori hanno infine stabilito che la malattia è causata da un ceppo distinto di prioni prodotti dai bovini ammalati.
Gli scienziati avevano sospettato che le forme prioniche di una proteina chiamata alfa-sinucleina contribuiscono al Parkinson e ad altre condizioni, e le versioni prioniche delle proteine SOD1 e TDP43 possono causare la sclerosi laterale amiotrofica, conosciuta anche come morbo di Lou Gehrig. Gli scienziati hanno anche individuato ciuffi tau in 25 diverse malattie neurodegenerative, chiamate collettivamente taupatie. Questo ha suggerito il potenziale comportamento prionico della tau.
Nel 2009, il gruppo di Diamond ha rilevato che la tau si piega erroneamente in varie forme diverse in provetta. “Quando abbiamo infettato una cellula con una di queste copie deformi di tau e abbiamo permesso alla cellula di riprodursi, le cellule figlie contenevano copie di tau misfolded [mal ripiegate] allo stesso modo della cellula madre”, ha detto Diamond. “Inoltre, se estraiamo la tau da una cellula colpita, potremmo reintrodurla in una cellula normale, dove ricreerebbe la stessa forma aggregata. Ciò dimostra che ognuna di queste copie di forma diversa della proteina tau può formare ceppi di prioni stabili, come un virus o un batterio, che possono essere trasmessi indefinitamente”.
Diamond ha usato i prioni tau prodotti dalle cellule per infettare il cervello di topi, dimostrando che ceppi di forma diversa causano diversi livelli di danno cerebrale. Ha isolato i prioni dai topi, li ha fatti crescere in coltura cellulare, e poi ha infettato altri topi. Durante questi trasferimenti, ogni particolare prione continua ad essere mal ripiegato nella stessa forma e causa danni allo stesso modo.
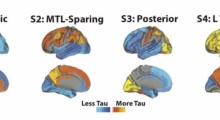
Infine, i ricercatori hanno esaminato ciuffi di tau nel cervello di 28 pazienti dopo la loro morte. Ciascuno dei pazienti era noto per avere una delle cinque forme di tauopatia. “Ogni malattia aveva un ceppo di prione tau unico o una combinazione di ceppi ad esso associati”, ha detto. “Per esempio, abbiamo isolato lo stesso ceppo del prione tau da quasi tutti i pazienti con Alzheimer che abbiamo esaminato”. In genere anche i campioni di cervello di pazienti con la degenerazione neurologica progressiva cortico-basale e la malattia di Pick avevano gli stessi ceppi di prioni tau o miscele di ceppi.
Diamond e altri stanno ora lavorando per trovare un modo per isolare i prioni tau in modo non invasivo dalle persone per fini diagnostici. Le opzioni per fermare i prioni sono gli anticorpi monoclonali, che potrebbero marcare i prioni per essere disattivati o per l’attacco e la rimozione da parte del sistema immunitario (rif. studio Diamond e David Holtzman, MD, preside di Neurologia, in Neuron 2013). Sia Diamond che gli altri stanno sviluppando dei modi per bloccare il movimento dei prioni tau tra le cellule e impedire alle cellule da produrre nuove copie delle proteine prioniche.
Fonte: Michael C. Purdy in Washington University Saint Louis (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Sanders DW, Kaufman SK, DeVos SL, Sharma AM, Mirbaha H, Li A, Barker SJ, Foley AC, Thorpe JR, Serpell LC, Miller TM, Grinberg LT, Seeley WW, Diamond ML. Distinct tau prion strains propagate in cells and mice and define different tauopathies.Neuron, online May 22, 2014. DOI: http://dx.doi.org/10.1016/j.neuron.2014.04.047
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |






 Associazione Alzheimer OdV
Associazione Alzheimer OdV