Si potrebbe presumere che liberare una cellula cerebrale dalle proteine danneggiate sarebbe sempre positivo, e che ostacolare la capacità della cellula di farlo provocherebbe l'accumulo delle proteine difettose all'interno della cellula, probabilmente a livelli tossici.
Quindi molto impegno scientifico si è concentrato sul modo per migliorare il processo attraverso il quale le cellule eliminano le proteine scoppiate.
Ma questo modo di pensare potrebbe dover essere rivisto, secondo un nuovo studio della School of Medicine della Stanford University. L'autore senior Sudhof Thomas, MD, professore di fisiologia molecolare e cellulare, e i suoi colleghi ricercatori hanno inaspettatamente trovato che, inibire il processo attraverso il quale le proteine danneggiate vengono normalmente scomposte all'interno delle cellule, ritarda l'insorgenza dei sintomi nei topi di laboratorio che sono molto inclini alla neurodegenerazione e ne aumenta significativamente la longevità.
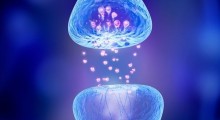
Lo studio, pubblicato online il 15 agosto su Science Translational Medicine, ha anche dimostrato che bloccare l'attività dei tritarifiuti interni delle cellule (conosciuti in biologia come proteasomi - vedi sopra una rappresentazione grafica da Wikipedia) nelle cellule nervose prelevate dai topi predisposti alla neurodegenerazione restaura molte caratteristiche biochimiche cruciali necessarie per la funzione sana delle cellule. Anche se Sudhof avverte che sono necessarie ulteriori ricerche, i risultati rappresentano una sfida alle idee prevalenti circa la patologia di alcune malattie neurodegenerative. "Il consenso corrente nelle neuroscienze favorisce una strategia terapeutica di cercare di accelerare, anziché ostacolare, lo smaltimento delle proteine danneggiate che si accumulano nel cervello dei pazienti con Alzheimer, Parkinson, corea di Huntington e altre malattie neurodegenerative", ha detto Sudhof, che è anche Professore Avram Goldstein alla School of Medicine.
I proteasomi sono componenti delle cellule che distruggono le proteine danneggiate. Non solo le cellule nervose, ma praticamente tutte le cellule nelle creature che vanno dal lievito all'uomo, contengo moltitudini di questi piccole macchine a forma di tubo, che succhiano le proteine difettose nei loro buchi e li tagliano in frammenti. Esaminando il tessuto cerebrale di pazienti di Alzheimer e di Parkinson defunti, il gruppo di Sudhof ha osservato che era in corso un aspetto del processo degenerativo identico a quello che avevano impedito nei topi di laboratorio, suggerendo che i loro risultati nel modello animale potrebbero risultare rilevanti pure per queste e altre malattie umane.
La proteina difettosa particolare la cui demolizione è stata evitata nello studio di Sudhof, è la SNAP-25, che svolge un ruolo chiave nel rilascio di segnali chimici che le cellule nervose utilizzano per comunicare una con l'altra. Ma come tutte le proteine, la SNAP-25 non può fare il suo lavoro fino a quando non viene costretta ad assumere una forma. "La struttura equivale alla funzione" è una parola d'ordine della biochimica. Le proteine - le creature molecolari che fanno il grosso del lavoro in ogni cellula vivente - sono inizialmente prodotte come lunghe sequenze lineari di subunità chimiche di piccole dimensioni che progressivamente vengono legate insieme come perle di una collana. Ma la stringa rimane solo una stringa fino a quando non assume una specifica struttura, in genere con l'aiuto di uno o più molecole "chaperone" che la guidano alla sua conformazione corretta. Come i piedi di un postino, le proteine oberate di lavoro possono finalmente andare liscie. Le proteine misfolded [mal ripiegate] e quindi non più funzionali possono, in alternativa, essere rapidamente recondizionate e rimesse al lavoro o essere chimicamente etichettate, come con un "codice a barre", per essere demolite dai proteasomi.
La SNAP-25 viene utilizzata da molti tipi di cellule, ma lavora duramente in particolare nelle cellule nervose, o neuroni. Per trasmettere segnali tra loro, i neuroni rilasciano sostanze chimiche specializzate in piccoli spazi chiamati sinapsi che separano un neurone dall'altro come un relè. Prima del rilascio, queste sostanze chimiche vengono sequestrate in pacchetti, o vescicole, tenute dalla membrana, all'interno del neurone. Ogni volta che un neurone trasmette un segnale al successivo - che può avvenire più di 100 volte al secondo - centinaia di piccole vescicole confezionate chimicamente si avvicinano al bordo del primo neurone e si fondono con la sua membrana esterna. Una superficie interna di una vescicola fusa diventa parte della superficie esterna del neurone (come accadrebbe se una piccola bolla si fondesse con una più grande che la circonda), ed i suoi contenuti memorizzati fuoriescono nella sinapsi.
Perché ciò accada, le vescicole devono essere costrette attivamente a mettersi a stretto contatto con le membrane dei neuroni. Ciò viene realizzato da un gruppo di proteine che sono l'equivalente molecolare di un morsetto. Nel corso di ripetuti impulsi di scariche neuronali, la SNAP-25 (un elemento chiave di questo complesso di serraggio) può piegarsi in modo errato, rendendo inutile l'intero processo di aggancio. Più un neurone si accende, più le molecole di SNAP-25 si deformano nel tempo.
Alcuni anni fa, il gruppo di Sudhof ha utilizzato una sofisticata tecnica genetica per creare un ceppo di topi di laboratorio privi di una molecola chaperone che aiuta a guidare il ripiegamento corretto della SNAP-25. Questi topi sembrano abbastanza normali nei primi anni di vita. Ma il fallimento graduale dell'azione di serraggio necessaria per la fusione delle vescicole e per la segnalazione neuronale fa sì che i neuroni moiano, innescando infine i sintomi comportamentali e la morte precoce. Sudhof ha ampiamente utilizzato questi topi come sistema modello per comprendere le proteine mal ripiegate e le malattie degenerative.
Nel nuovo studio, iniettare nei topi carenti di chaperone uno dei due farmaci inibitori del proteasoma (lactacistina e epoxomicina) una volta ogni cinque giorni (probabilmente lontano da un regime ottimale, ma almeno un esperimento animale fattibile, secondo Sudhof) ha ritardato i tipici sintomi esteriori della loro malattia neurodegenerativa fino al 30 per cento e ha prolungato la sopravvivenza di quasi il 20 per cento. Successivamente, i ricercatori hanno incubate neuroni dei topi sperimentali in soluzioni con o senza farmaci inibitori del proteasoma. Misurazioni biochimiche hanno mostrato che, anche se la quantità complessiva di SNAP-25 nei neuroni incubati con o senza farmaci era la stessa, l'attività del complesso di bloccaggio è stata ripristinata a livelli normali nei neuroni impregnati di farmaco. (Nelle neuroni senza farmaco l'attività di aggancio è rimasta enormemente compromessa).
E' chiaro che impedire la scomposizione delle molecole SNAP-25 mal ripiegate ne ha aumentato i livelli nei neuroni - un risultato che si potrebbe intuitivamente ritenere come tossico, dice Sudhof. Ma gli esperimenti del nuovo studio, invece suggeriscono che le proteine mal ripiegate, sia casualmente essendo solo respinte in giro nell'ambiente circostante, sia con l'assistenza attiva di molecole chaperone "generiche", possono tornare alle forme normali e tornare nella mischia. Con l'accumulo nella cellula di SNAP-25 difettose, una parte crescente ne viene riparata, con implicazioni benefiche a valle dell'attività molecolare di aggancio, per la fusione della membrana delle vescicole e una migliore segnalazione chimica dei neuroni. Poiché i neuroni devono segnalare in modo efficace per sopravvivere, ne muoiono di meno.
Un certo numero di patologie neurodegenerative come l'Alzheimer, il Parkinson e l'Huntington sono associate alla presenza di proteine danneggiate. È opinione diffusa tra i ricercatori nel settore che l'accumulo di queste proteine danneggiate contribuisce sostanzialmente al processo patologico. Sudhof avverte che, anche se è possibile che i farmaci inibitori del proteosoma potrebbero, paradossalmente, rivelarsi un rallentamento del progresso di queste ed altre condizioni degenerative umane, questo è ben lungi dall'essere dimostrato. Tuttavia per alcune indicazioni tumorali sono già in uso clinico farmaci inibitori del proteasoma molto più potenti rispetto ai vecchi farmaci fuori licenza che Sudhof e i suoi colleghi hanno dato ai topi sperimentali, quindi potrebbero essere rapidamente implementati in studi preclinici che testano questa possibilità.
Il primo autore dello studio, finanziato dal National Institute on Aging, è Manu Sharma, PhD, studioso postdottorato; co-autrice Jacqueline Burre, PhD, ricercatrice postdottorato.
***********************
Cosa pensi di questo articolo? Ti è stato utile? Hai rilievi, riserve, integrazioni? Conosci casi o ti è successo qualcosa che lo conferma? o lo smentisce? Puoi usare il modulo dei commenti qui sotto per dire la tua opinione. Che è importante e unica.
***********************
Fonte: Materiale del Stanford University Medical Center. Articolo originale scritto da Bruce Goldman.
Riferimento: Manu Sharma, Jacqueline Burré, and Thomas C. Südhof. Proteasome Inhibition Alleviates SNARE-Dependent Neurodegeneration. Science Translational Medicine, 2012; DOI: 10.1126/scitranslmed.3004028.
Pubblicato in ScienceDaily il 15 Agosto 2012 - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari proposti da Google sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |




 Associazione Alzheimer OdV
Associazione Alzheimer OdV