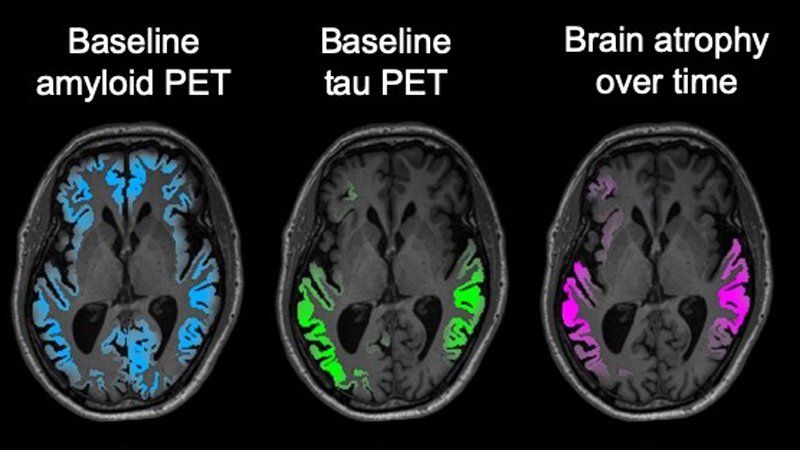
 Scansioni PET della tau cerebrale (verdi) all'inizio della fase clinica dell'Alzheimer prevedono con precisione il punto dell'atrofia cerebrale misurata con la risonanza magnetica 1-2 anni più tardi (magenta). La scansione PET dell'amiloide (blu) non predice la posizione né della tau né della futura atrofia cerebrale.
Scansioni PET della tau cerebrale (verdi) all'inizio della fase clinica dell'Alzheimer prevedono con precisione il punto dell'atrofia cerebrale misurata con la risonanza magnetica 1-2 anni più tardi (magenta). La scansione PET dell'amiloide (blu) non predice la posizione né della tau né della futura atrofia cerebrale.
La scansione cerebrale dei 'grovigli' patologici della proteina tau prevede in modo affidabile la posizione della futura atrofia cerebrale nei pazienti con morbo di Alzheimer (MA), un anno o più in anticipo, secondo un nuovo studio condotto da scienziati della University of California di San Francisco.
Al contrario, la posizione delle 'placche' di amiloide, che da decenni sono al centro della ricerca e dello sviluppo di farmaci per il MA, è risultata essere di scarsa utilità nel predire come si dispiegherà il danno col progredire della malattia.
I risultati dello studio, pubblicati il 1 gennaio 2020 in Science Translational Medicine, danno forza al crescente riconoscimento da parte dei ricercatori che la tau guida la degenerazione del cervello nel MA più direttamente della proteina amiloide, e al tempo stesso dimostra il potenziale della PET (tomografia a emissione di positroni) per la tau sviluppata di recente, per accelerare gli studi clinici del MA e migliorare la cura individualizzata del paziente.
“La corrispondenza tra la diffusione della tau e ciò che è accaduto al cervello l'anno successivo è stata davvero sorprendente”, ha detto il neurologo Gil Rabinovici MD, professore distinto di memoria e invecchiamento e leader del programma di scansione PET della UC. “La PET tau ha predetto non solo quanta atrofia avremmo visto, ma anche dove sarebbe accaduta. Queste previsioni erano molto più potenti di qualsiasi altro metodo di scansione disponibile, e si aggiungono alla prove che la tau è uno dei principali motori della malattia”.
L'interesse per la tau cresce mentre le terapie basate sull'amiloide barcollano
I ricercatori di MA stanno da tempo dibattendo sull'importanza relativa delle placche amiloidi e dei grovigli di tau, due tipi di grumi di proteine mal ripiegate osservati negli studi post-mortem del cervello dei pazienti, entrambi identificati per la prima volta da Alois Alzheimer nel 20° secolo. Per decenni, il 'campo amiloide' ha dominato, portando a molteplici sforzi per rallentare il MA con farmaci che puntavano l'amiloide, tutti con risultati deludenti o alterni.
Molti ricercatori hanno rivolto la loro attenzione alla proteina tau, una volta liquidata come una semplice 'pietra tombale' che marcava le cellule morenti, e stanno indagando se la tau può in effetti essere una guida biologica importante della malattia. A differenza dell'amiloide, che si accumula ampiamente nel cervello, a volte anche nelle persone senza sintomi, le autopsie dei malati di MA hanno rivelato che la tau è concentrata esattamente dove l'atrofia cerebrale è più grave, e in luoghi che aiutano a spiegare le differenze nei sintomi dei pazienti (nelle aree linguistiche e nelle regioni relative alla memoria, per esempio).
“Nessuno dubita che l'amiloide abbia un ruolo nel MA, ma sempre più scoperte sulla tau stanno cominciando a spostare il modo in cui i ricercatori pensano a ciò che sta realmente guidando la malattia”, ha spiegato Renaud La Joie PhD, ricercatore post-dottorato del laboratorio di Rabinovici, e primo autore del nuovo studio. “Eppure, guardando solo il tessuto cerebrale post-mortem, è difficile provare che i grovigli tau causano la degenerazione del cervello e non il contrario. Uno degli obiettivi principali del nostro gruppo è stato sviluppare strumenti non invasivi di scansione cerebrale che permettano di vedere se la posizione dell'accumulo di tau nelle prime fasi della malattia prevede la degenerazione successiva del cervello”.
Scansioni PET Tau prevedono le sedi della futura atrofia cerebrale nei singoli pazienti
Nonostante le prime perplessità che potrebbe essere impossibile misurare la tau nel cervello vivente, gli scienziati hanno recentemente sviluppato una molecola iniettabile chiamata flortaucipir - attualmente in fase di revisione da parte della FDA - che si lega alla tau malripiegata nel cervello ed emette un segnale radioattivo mite che può essere rilevato dalla scansione PET.
Rabinovici e il collaboratore William Jagust MD, della UC Berkeley e del Lawrence Berkeley National Laboratory, sono stati tra i primi ad adottare la scansione PET tau per studiare la distribuzione dei grovigli tau nel cervello che invecchia normalmente e in uno studio trasversale più piccolo di malati di MA. Il loro nuovo studio rappresenta il primo tentativo di verificare se i livelli di tau nei malati di MA è in grado di prevedere la degenerazione futura del cervello.
La Joie ha reclutato 32 partecipanti con MA di stadio clinico precoce attraverso il Centro Memoria e Invecchiamento dell'UCSF, ognuno dei quali ha ricevuto scansioni PET con due traccianti diversi, per misurare i livelli di amiloide e tau nel cervello. I partecipanti hanno inoltre avuto scansioni MRI per misurare l'integrità strutturale del cervello, sia all'inizio dello studio, che di nuovo nelle visite successive, uno o due anni dopo.
I ricercatori hanno scoperto che i livelli complessivi di tau nel cervello dei partecipanti all'inizio dello studio hanno predetto quanta degenerazione ci sarebbe stata al momento della visita successiva (in media 15 mesi dopo). Inoltre, i modelli locali di accumulo di tau hanno predetto la successiva atrofia nelle stesse posizioni con una precisione superiore al 40%. Al contrario, le scansioni PET dell'amiloide al basale hanno predetto correttamente solo il 3% della degenerazione futura del cervello.
“Vedere che l'accumulo di tau prevede dove ci sarà la degenerazione è la conferma della nostra ipotesi che la tau è un fattore chiave della neurodegenerazione nel MA”, ha detto La Joie.
In particolare, le scansioni PET hanno rivelato che i partecipanti più giovani allo studio avevano livelli complessivi più alti di tau nel cervello, così come un legame più forte tra la tau al basale e la successiva atrofia cerebrale, rispetto ai partecipanti più anziani. Questo suggerisce che altri fattori - probabilmente altre proteine anomale o lesioni vascolari - possono avere un ruolo più importante nell'insorgenza tardiva del MA, dicono i ricercatori.
La capacità di predire l'atrofia cerebrale è uno ‘strumento prezioso di medicina di precisione’
I risultati aumentano le speranze che i farmaci che puntano la tau, attualmente in fase di studio all'UCSF e altrove, possano dare benefici clinici ai pazienti, bloccando questo fattore chiave della neurodegenerazione nella malattia. Allo stesso tempo, la possibilità di usare la PET tau per prevedere la degenerazione successiva del cervello potrebbe consentire una cura della demenza più personalizzata e velocizzare gli studi clinici in corso, dicono gli autori.
“Una delle prime cose che la gente vuole sapere quando sente una diagnosi di MA è semplicemente cosa riserva il futuro a sé o ai propri cari. Sarà una lunga dissolvenza della memoria, o un rapido declino nella demenza? Quanto tempo il paziente è in grado di vivere in modo indipendente? Sarà in grado di perdere la capacità di parlare o di andare in giro da solo? Queste sono domande alle quali al momento non possiamo rispondere, se non in termini generici“, ha detto Rabinovici. “Ora, per la prima volta, questo strumento potrebbe farci dare ai pazienti un senso di cosa aspettarsi, rivelando il processo biologico alla base della loro malattia”.
Rabinovici e il suo team prevedono, inoltre, che la capacità di predire la futura atrofia nel cervello sulla base della scansione PET tau consentirà agli studi clinici di MA di valutare rapidamente se un trattamento sperimentale può alterare la traiettoria specifica prevista per il singolo paziente, cosa attualmente impossibile a causa della larga variabilità nel modo in cui la malattia progredisce da individuo a individuo. Tali informazioni potrebbero consentire di regolare il dosaggio o passare a un diverso composto sperimentale se il primo trattamento non influisce sui livelli di tau o non altera la traiettoria prevista nell'atrofia cerebrale del paziente.
“La scansione PET Tau potrebbe essere uno strumento di medicina di precisione estremamente prezioso per i futuri studi clinici”, ha detto Rabinovici. “La capacità di rilevare in modo sensibile l'accumulo di tau nei pazienti viventi potrebbe permettere per la prima volta ai ricercatori clinici di individuare trattamenti che possono rallentare o addirittura impedire il modello specifico di atrofia cerebrale previsto per ogni paziente".
.
Fonte: Nicholas Weiler in University of California San Francisco (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Renaud La Joie, Adrienne V. Visani, Suzanne L. Baker, Jesse A. Brown, Viktoriya Bourakova, Jungho Cha, Kiran Chaudhary, Lauren Edwards, Leonardo Iaccarino, Mustafa Janabi, Orit H. Lesman-Segev, Zachary A. Miller, David C. Perry, James P. O’Neil, Julie Pham, Julio C. Rojas, Howard J. Rosen, William W. Seeley, Richard M. Tsai, Bruce L. Miller, William J. Jagust and Gil D. Rabinovici. Prospective longitudinal atrophy in Alzheimer’s disease correlates with the intensity and topography of baseline tau-PET. Science Translational Medicine, 1 Jan 2020, DOI
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.











 Associazione Alzheimer OdV
Associazione Alzheimer OdV