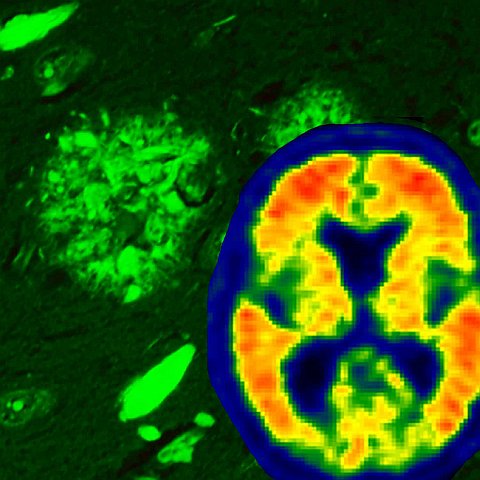
 La patologia dell'Alzheimer secondo la microscopia a fluorescenza thioflavin-S, che mostra sia i grovigli neurofibrillari (strutture a forma di fiamma) che le placche amiloidi (strutture arrotondate). Nell'immagine a destra, la scansione cerebrale mostra l'accumulo di amiloide nel cervello di individui viventi (i colori più caldi).Esaminando più di 3.600 cervelli post-mortem, i ricercatori della Mayo Clinic di Jacksonville e di Rochester hanno scoperto che è la progressione della proteina tau disfunzionale a guidare il declino e la perdita di memoria cognitiva dell'Alzheimer.
La patologia dell'Alzheimer secondo la microscopia a fluorescenza thioflavin-S, che mostra sia i grovigli neurofibrillari (strutture a forma di fiamma) che le placche amiloidi (strutture arrotondate). Nell'immagine a destra, la scansione cerebrale mostra l'accumulo di amiloide nel cervello di individui viventi (i colori più caldi).Esaminando più di 3.600 cervelli post-mortem, i ricercatori della Mayo Clinic di Jacksonville e di Rochester hanno scoperto che è la progressione della proteina tau disfunzionale a guidare il declino e la perdita di memoria cognitiva dell'Alzheimer.
L'amiloide, l'altra proteina tossica che caratterizza l'Alzheimer, si accumula con il progredire della demenza, ma non è il principale colpevole, essi dicono.
I risultati, pubblicati sulla rivista Brain, offrono nuove e preziose informazioni nel lungo e continuo dibattito sul contributo relativo dell'amiloide e della tau allo sviluppo e alla progressione della disfunzione cognitiva dell'Alzheimer, secondo l'autrice principale dello studio, Melissa Murray, PhD, neuroscienziato della Mayo Clinic di Jacksonville.
I ricercatori affermano che i risultati suggeriscono anche che arrestare la tau tossica dovrebbe essere un nuovo punto di riferimento per il trattamento dell'Alzheimer.
"La maggior parte del settore di ricerca di Alzheimer si è molto concentrata sull'amiloide nel corso degli ultimi 25 anni", afferma al Dott.ssa Murray. "Inizialmente, i pazienti che hanno dimostrato di avere mutazioni o cambiamenti nel gene amiloide hanno evidenziato una grave patologia di Alzheimer, in particolare un aumento dei livelli di amiloide. Le scansioni cerebrali effettuate negli ultimi dieci anni hanno rivelato che l'amiloide si accumula con la progressione della malattia, e quindi la maggior parte dei modelli di Alzheimer si sono basati sulla tossicità amiloide. In questo modo, il settore dell'Alzheimer è diventato miope".
Ma i ricercatori della Mayo Clinic sono riusciti ad esaminare contemporaneamente l'evoluzione dell'amiloide e della tau usando misurazioni neuropatologiche. "Immaginiamo di guardare gli anelli di un albero; dalla sezione dell'albero si possono identificare gl schemi, come il cambiamento delle stagioni e l'invecchiamento della struttura", dice la dott.ssa Murray. "Studiare il cervello nelle diverse fasi dell'Alzheimer ci dà una prospettiva dell'impatto cognitivo di una vasta gamma di gravità sia dell'amiloide che della tau, e siamo stati molto fortunati ad avere le risorse della banca del cervello della Mayo, alla quale migliaia di persone hanno donato il cervello post-mortem, permettendoci di capire i cambiamenti della tau e dell'amiloide che si verificano nel tempo".
"La tau può essere paragonata alle traversine ferroviarie che stabilizzano un binario del treno usato dalle cellule cerebrali per trasportare il cibo, i messaggi e altre merci fondamentali nei neuroni", dice la dott.ssa Murray. "Nell'Alzheimer, i cambiamenti della proteina tau inducono i binari a diventare instabili nei neuroni dell'ippocampo, il centro della memoria. La tau anomala si accumula nei neuroni, portando infine questi neuroni alla morte. L'evidenza suggerisce che la proteina tau anomala si diffonde poi da cellula a cellula nella corteccia cerebrale. La corteccia è la parte esterna del cervello che è coinvolta nei livelli più elevati di pensiero, di pianificazione, di comportamento e di attenzione, riflettendo le variazioni comportamentali successive dei malati di Alzheimer".
"L'amiloide, invece, inizia ad accumularsi nelle parti esterne della corteccia e poi si diffonde verso l'ippocampo ed infine ad altri settori", dice. "Il nostro studio dimostra che l'accumulo di amiloide ha una forte relazione con un calo della cognizione. Quando si tiene conto della gravità della patologia tau, tuttavia, il rapporto tra amiloide e cognizione scompare, indicando così che è la tau il vero motore dell'Alzheimer", dice la dott.ssa Murray.
La scansione cerebrale amiloide è usata solo da circa dieci anni, e "quindi ci sono ancora molte domande senza risposta circa quello che sta misurando", aggiunge. "Indagare su quale patologia cerebrale sta sotto alla soglia di scansione cerebrale dell'amiloide, che indica l'Alzheimer, può essere affrontato solo nei pazienti sottoposti a scansione e che hanno donato il loro cervello per la ricerca".
Lo studio è stato condotto in due parti. I ricercatori della Mayo Clinic della Florida hanno esaminato 3.618 cervelli della sua banca di cervelli post-mortem, che comprendeva 1.375 cervelli con Alzheimer confermato. Questi pazienti sono morti a diverse età e con diverse fasi di demenza, fornendo una tempistica preziosa nella progressione della malattia.
I ricercatori hanno usato sistemi di punteggio raccomandati per esaminare l'evoluzione dell'amiloide e della tau nel tessuto cerebrale sezionato. Essi hanno scoperto che la gravità della tau, e non dell'amiloide, può predire l'età di insorgenza del declino cognitivo, la durata della malattia e il deterioramento mentale.
La seconda parte dello studio è stata eseguita dai loro collaboratori di Rochester. Insieme il team ha esaminato le scansioni cerebrali amiloidi prese ai pazienti prima della morte e le hanno confrontate con le misurazioni delle patologie cerebrale tau e amiloide.
I ricercatori hanno riscontrato che il segnale dalle scansioni cerebrali amiloidi corrispondeva con una patologia amiloide specifica del cervello e non con l'amiloide dei vasi capillari, e non corrispondeva alla patologia della tau. Il cervello di alcuni partecipanti aveva l'amiloide a un livello di patologia non sufficiente a raggiungere la soglia di quello che si trova nelle scansioni cerebrali di Alzheimer. Questo è importante, in quanto l'amiloide può essere presente nel cervello di individui anziani che non hanno vissuto il declino cognitivo, dicono i ricercatori.
"I nostri risultati evidenziano la necessità di concentrarsi sulla tau per fini terapeutici, ma indica anche che in ogni caso l'attuale metodo di scansione cerebrale amiloide offre informazioni valide nel monitoraggio dell'Alzheimer", dice la dott.ssa Murray. "Anche se la tau vince il premio di «cattivo» dalle risultanze del nostro studio, è anche vero che la scansione cerebrale amiloide può essere usata per garantire che i pazienti che si iscrivono alla sperimentazione clinica soddisfino una soglia di amiloide coerente con l'Alzheimer, al posto di un marcatore della tau".
******
Hanno collaborato Neill Graff-Radford MD, Amanda Liesinger, Ashley Cannon PhD, Bhupendra Rawal MS, Owen Ross PhD, e Dennis Dickson MD della Mayo Clinic di Jacksonville; Val Lowe MD, Scott Przybelski, Giuseppe Parisi MD, Ronald Petersen MD, PhD, Kejal Kantarci MD, David Knopman MD e Clifford Jack, Jr., MD dalla Mayo Clinic di Rochester; Ranjan Duara MD, del Mount Sinai Medical Center.
Lo studio è stato finanziato dai National Institutes of Health, dalla Mangurian Foundation, dal Robert H. and Clarice Smith and Abigail vanBuren Alzheimer’s Disease Research Program, dalla lsie and Marvin Dekelboum Family Foundation, dalla Donors Cure Foundation, e dalla The Alexander Family.
Fonte: Mayo Clinic (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Melissa E. Murray, Val J. Lowe, Neill R. Graff-Radford, Amanda M. Liesinger, Ashley Cannon, Scott A. Przybelski, Bhupendra Rawal, Joseph E. Parisi, Ronald C. Petersen, Kejal Kantarci, Owen A. Ross, Ranjan Duara, David S. Knopman, Clifford R. Jack, Dennis W. Dickson. Clinicopathologic and 11C-Pittsburgh compound B implications of Thal amyloid phase across the Alzheimer’s disease spectrum. Brain, 24 March 2015. DOI: http://dx.doi.org/10.1093/brain/awv050
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.













 Associazione Alzheimer OdV
Associazione Alzheimer OdV