Nei grumi chiamati amiloidi, le proteine prioniche sono associate a malattie come l'Alzheimer, l'Huntington e il Parkinson.
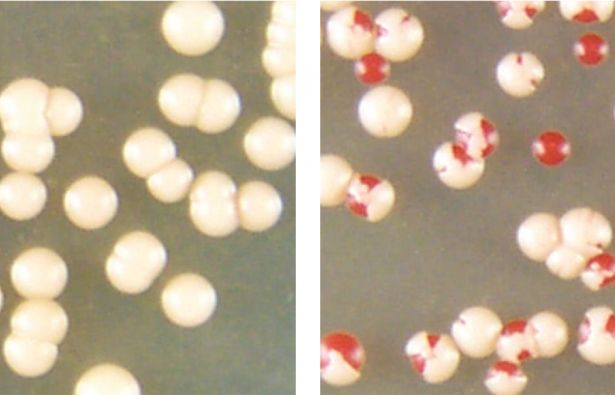 Quando le colonie di cellule del lievito del fornaio che contengono proteine prioniche aggregate (colonie di cellule bianche sulla sinistra) sono sollecitate da alte temperature, alcune di esse possono convertire le proteine prioniche aggregate in una forma non-aggregata della proteina (cellule rosse nelle colonie a destra). Fonte: Serio laboratory/ UA molecular and cellular biology
Quando le colonie di cellule del lievito del fornaio che contengono proteine prioniche aggregate (colonie di cellule bianche sulla sinistra) sono sollecitate da alte temperature, alcune di esse possono convertire le proteine prioniche aggregate in una forma non-aggregata della proteina (cellule rosse nelle colonie a destra). Fonte: Serio laboratory/ UA molecular and cellular biology
Le cellule del lievito a volte possono invertire l'errata piegatura [misfolding] e l'aggregazione delle proteine associate a malattie come l'Alzheimer, secondo una nuova ricerca della University of Arizona (UA). La nuova scoperta contraddice l'idea che, una volta che le proteine prioniche si sono modificate nella forma aggregante, il cambiamento è irreversibile.
"Si pensava che quando nascono questi aggregati le cellule non possono più sbarazzarsi di loro", ha detto Tricia Serio, professore della UA e capo del Dipartimento di Biologia Molecolare e Cellulare. "Abbiamo dimostrato che non è così. Le cellule possono eliminare da sè stesse questi aggregati".
I prioni sono proteine che si trasformano in una forma che induce anche i loro vicini a cambiare. In questa nuova forma, le proteine si raggruppano. Gli aggregati, chiamati amiloidi, sono associati a varie malattie come l'Alzheimer, la corea di Huntington e il Parkinson. "La proteina prionica è un po' come il dottor Jekyll e Mr. Hyde", ha detto la Serio, autrice senior dello studio pubblicato il 9 dicembre sulla rivista eLife. "Quando diventa Hyde, tutta la proteina prionica prodotta in seguito è piegata in modo errato".
I ciuffi di amiloide non sono fatali per il lievito.
La Serio ed i suoi studenti hanno esposto le cellule di lievito di birra contenenti amiloide a 40°C, una temperatura che sarebbe da febbre alta in un essere umano. Se esposte a questo ambiente, le cellule attivano una risposta allo stress che fanno tornare le proteine agglomerate di nuovo alla forma non-aggregata.
La scoperta suggerisce che indurre artificialmente le risposte allo stress potrebbe aiutare un giorno a sviluppare trattamenti per le malattie associate alle proteine prioniche mal ripiegate, ha detto la Serio. "Stiamo cercando di sviluppare terapie che inducono artificialmente la risposta allo stress. Il nostro lavoro serve come prova di principio che si tratta di un percorso fruttuoso da seguire".
Fonte: Mari N. Jensen in University of Arizona (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Courtney L Klaips, Megan L Hochstrasser, Christine R Langlois, Tricia R Serio. Spatial quality control bypasses cell-based limitations on proteostasis to promote prion curing. eLife, 2014; 3 DOI: 10.7554/eLife.04288
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |











 Associazione Alzheimer OdV
Associazione Alzheimer OdV