Il degrado incontrollato o inesatto delle proteine cellulari può portare a malattie come il cancro o l'Alzheimer.
Gli scienziati del Max Planck Institute of Biochemistry (MPIB) di Martinsried, vicino a Monaco in Germania, hanno scoperto la struttura e il meccanismo di funzionamento di una componente importante della macchina umana della degradazione cellulare, la peptidasi II tripeptidilica (TPPII).
"La decodifica della struttura della TPPII è una pietra miliare fondamentale per comprendere la complessa attivazione e il controllo della degradazione delle proteine", spiega Beate Rockel, scienziato del MPIB. I risultati dello studio sono stati pubblicati nella rivista Structure.
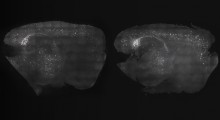
 Modello 3D del complesso TPPII umano attivo. Graphic: Beate Rockel, Copyright: MPI of Biochemistry |
Le proteine, i mattoni e le macchine molecolari della cellula, sono costituite da lunghe catene di amminoacidi. Quando tale catena deve essere degradata, essa viene prima dispiegata e poi scissa in piccoli pezzi, i cosiddetti peptidi. La peptidasi II tripeptidilica (TPPII), che è stata analizzata dagli scienziati del dipartimento del direttore del MPIB Wolfgang Baumeister, è uno dei fattori che si prendono cura dell'ulteriore degradazione. Taglia i peptidi in pezzetti più piccoli che, dopo alcuni passaggi aggiuntivi, possono essere riciclati per il montaggio di nuove proteine.
La TPPII è un grande complesso composto da 32-40 subunità identiche, che sono inattive in se stesse. Il complesso comincia a funzionare quando le subunità si uniscono in due trecce avvolte elicoidalmente una intorno all'altra. Il complesso è circa 100 volte più grande della maggior parte degli altri enzimi di degradazione delle proteine. "La TPPII è un vero gigante tra le proteine cellulari", dice il dottorando Anne-Marie Schönegge. "Risolvere la struttura di un tale colosso è un compito difficile".
Da un bit all'altro verso l'intera struttura
I ricercatori del MPIB hanno combinato diversi modelli e metodi di biologia strutturale per determinare la struttura e il meccanismo di funzionamento della TPPII in dettaglio. In collaborazione con scienziati del Lawrence Berkeley National Laboratory di Berkeley, avevano risolto con successo la struttura atomica delle subunità TPPII del moscerino della frutta con cristallografia a raggi X. In una fase successiva, questa struttura è servita come base per calcolare un modello di subunità TPPII umane.
Utilizzando la microscopia crioelettronica e la ricostruzioneuna della singola particella, gli scienziati sono stati in grado di determinare la struttura dei complessi TPPII completi e attivi del moscerino della frutta e degli esseri umani - ma solo a media risoluzione. Combinando la struttura dei complessi completi con i modelli atomici più dettagliati delle singole unità, i collaboratori del dipartimento di ricerca "Molecular Structural Biology " potrebbero ora risolvere l'organizzazione strutturale dettagliata della TPPII umane: le subunità racchiudono un sistema di cavità che attraversa l'intero complesso TPPII e ospita i siti catalitici.
Inserendo le strutture delle subunità inattive nella struttura del complesso attivo, gli scienziati hanno individuato le regioni che si suppone subiscano modifiche in fase di attivazione della TPPII. Queste regioni comprendono il sito attivo e gli ingressi nel sistema di cavità all'interno del complesso. Beate Rockel spera che questo lavoro possa dare anche altri benefici: "Comprendere la struttura delle TPPII potrebbe contribuire allo sviluppo di nuovi farmaci per il futuro, poiché ci sono indizi che le TPPII possono essere coinvolte in malattie come l'atrofia muscolare, l'adiposi e il cancro".
*************************
Cosa pensi di questo articolo? Ti è stato utile? Hai rilievi, riserve, integrazioni? Conosci casi o ti è successo qualcosa che lo conferma? o lo smentisce? Puoi usare il modulo dei commenti qui sotto per dire la tua opinione. Che è importante e unica.
************************
Fonte: Materiale del Max Planck Institute of Biochemistry, via AlphaGalileo.
Riferimenti: Crystal K Chuang, Beate Rockel, Gönül Seyit, Peter J Walian, Anne-Marie Schönegge, Jürgen Peters, Petrus H Zwart, Wolfgang Baumeister, Bing K Jap. Hybrid molecular structure of the giant protease tripeptidyl peptidase II. Nature Structural & Molecular Biology, 2010; 17 (8): 990 DOI: 10.1038/nsmb.1870.
Anne-Marie Schönegge, Elizabeth Villa, Friedrich Förster, Reiner Hegerl, Jürgen Peters, Wolfgang Baumeister, Beate Rockel. The Structure of Human Tripeptidyl Peptidase II as Determined by a Hybrid Approach. Structure, 2012; 20 (4): 593 DOI: 10.1016/j.str.2012.01.025.
Pubblicato in ScienceDaily il 4 aprile 2012 - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari proposti da Google sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |




 Associazione Alzheimer OdV
Associazione Alzheimer OdV