Diverse malattie neurodegenerative, come la demenza frontotemporale (FTD), la paralisi sopranucleare progressiva (PSP) e la degenerazione corticobasale (CBD), sono dovute all'accumulo di proteine tau anormali e mal ripiegate nel cervello. Un team di ricercatori guidati da scienziati della Università della California di Santa Barbara ha trovato modi potenziali per bloccare questo processo, puntando siti 'appiccicosi' sulla lunga forma di tau mutata, impedendo errata piegatura e diffusione dei grovigli neurofibrillari.
"Questa è una vera collaborazione tra biologia e chimica", ha affermato Kenneth S. Kosik, neuroscienziato della UCSB che ha pubblicato i risultati su PNAS-Proceedings of the National Academy of Sciences, con i professori di chimica Soni Han, Joan-Emma Shea e il professore di ingegneria chimica Scott Shell.
Lo studio presenta intuizioni a livello molecolare sul modo in cui si diffonde la tau patologica e, secondo i ricercatori, questa comprensione potrebbe portare a "un intervento terapeutico potenzialmente in grado di disaggregare la tau o prevenire la sua aggregazione" nella lunga forma in cui si accumula.
Una forcella appiccicosa
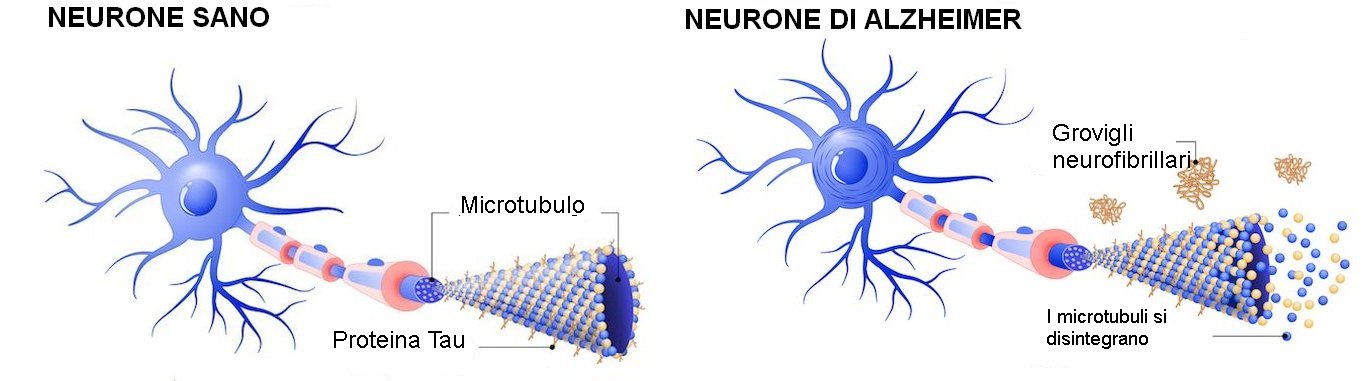
La tau è una proteina strutturale essenziale nel cervello, perché dà forma e stabilità alle cellule e consente il trasporto di nutrienti necessari. Tuttavia, quando muta e si piega in modo errato, può diventare appiccicosa e aggrovigliata.
In più, questo errore nel ripiegamento può diventare un modello per istruzioni difettose che dirigono le normali proteine di tau a piegarsi male e a raccogliersi fino a quando la condizione non si diffonde su ampie regioni del cervello, interferendo con le sue funzioni. Le posizioni specifiche in cui questi grovigli neurofibrillari si verificano nel cervello differiscono tra i diversi disturbi neurodegenerativi.
Esistono due forme particolari di tau, che fungono da punto di partenza per questa categoria di malattie neurodegenerative, chiamate tauopatie, delle quali il morbo di Alzheimer (MA) è la più nota. La tau è prodotta sia in una versione breve a 'tripla-ripetizione' (3R), sia in una versione a 'quadrupla ripetizione' (4R), più lunga; quest'ultima è al centro di questa ricerca.
Le tauopatie molto meno comuni del MA come FTD, PSP e CBD sono esclusivamente tauopatie del tipo 4R, sebbene le malattie neurodegenerative possano anche essere associate alla forma 3R o, come nel caso di MA, a una combinazione di entrambe. Le scoperte in questa ricerca riguardano malattie che accumulano tau 4R.
Unendo tecniche avanzate come la microscopia elettronica a trasmissione e le simulazioni di dinamiche molecolari con esperimenti in vitro che coinvolgono colture cellulari, il team di ricerca è riuscito a farsi un'idea delle condizioni in cui la tau 4R patologica inizia a mal ripiegarsi, a modellare altre proteine tau e ad aggregarsi.
"La tau si piega in un modo unico in ciascuna di queste malattie", ha spiegato Kosik. "Una parte di essa si piega in una struttura a forcina solo nella tau 4R. All'interno della forcella c'è un segmento appiccicoso chiamato PHF6 che può legare e impilare altre proteine di tau in grandi aggregati".
E se fosse possibile indurre l'aggregazione della tau nella coltura cellulare e usare il sistema per interferire con questo sito appiccicoso? "Creare condizioni per la propagazione della tau sarebbe un sistema produttivamente elevato per la scoperta di composti che possono interferire con l'aggregazione della tau", ha commentato Kosik.
I ricercatori hanno scoperto, ad esempio, che la sostituzione di un singolo aminoacido sulla proteina, vicino alla regione appiccicosa, era sufficiente per prevenire l'aggregazione della tau, indebolendo l'accesso alla porzione vulnerabile del peptide.
In altre indagini i ricercatori hanno anche scoperto che i nanocorpi (frammenti di anticorpi) sintetizzati dal sangue dei camelidi (cammelli, lama e altri membri della famiglia Camelidae) erano in grado di legarsi alla regione PHF6, inibendo l'aggregazione della tau. Qualunque sia la terapia, la regione che comprende il segmento forcina della tau 4R è l'apparente zona attiva da puntare.
I ricercatori hanno ancora molta strada davanti prima di riuscire a sviluppare e far approvare terapie mirate che inibiscono la formazione dei grovigli neurofibrillari caratteristici delle tauopatie. Ma i risultati di questo studio svelano entusiasmanti potenziali percorsi per arrestare le fasi critiche verso l'accumulo di tau mutante. "Vorremmo continuare a testare questa tecnologia in modelli animali", ha affermato Kosik, riconoscendo gli "enormi contributi" del ricercatore post-dottorato e primo autore Andrew Longhini alle idee e agli esperimenti riportati.
[...] Oltre a far avanzare la ricerca su alcune forme di malattie neurodegenerative, Kisik è ottimista che questi risultati possano fungere da punto di partenza per potenziali indizi verso le terapie per la malattia di PIck 3R e per il più complesso MA: "Cercheremo di applicare i nostri risultati alle forme più complicate", ha detto. "Ci arriveremo".
Fonte: Sonia Fernandez in University of California - Santa Barbara (> English) - Traduzione di Franco Pellizzari.
Riferimenti: AP Longhini, [+18], KS Kosik. Precision proteoform design for 4R tau isoform selective templated aggregation. PNAS, Apr 2024, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.








 Associazione Alzheimer OdV
Associazione Alzheimer OdV