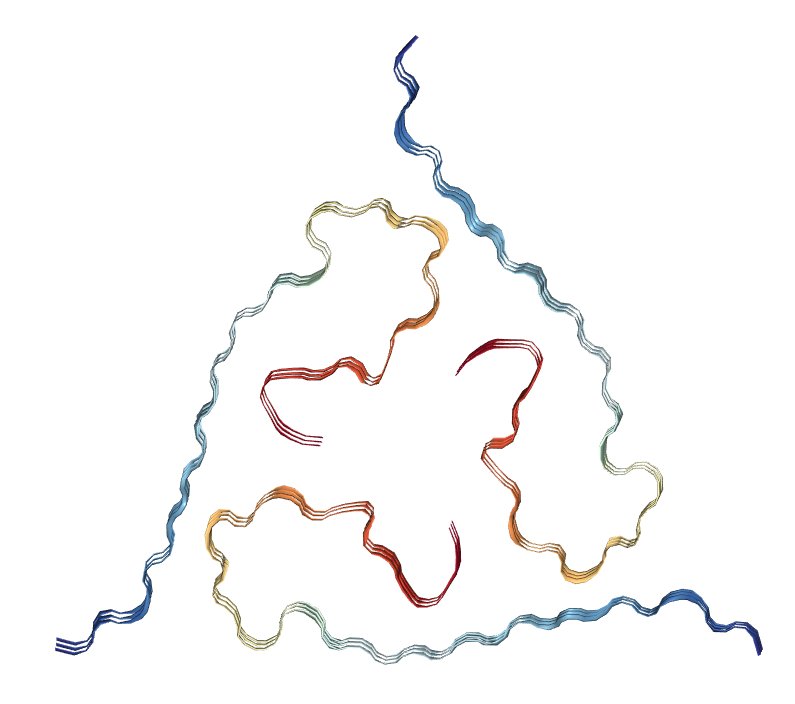
 Fibrille amiloidi (Lu et al, Tokyo)
Fibrille amiloidi (Lu et al, Tokyo)
Ricercatori dell'Università della Carolina del Nord di Chapel Hill hanno sviluppato una nuova piattaforma per veicolare farmaci che sfrutta le fibre elicoidali di amiloide progettate per sciogliere e rilasciare farmaci in risposta alle temperature del corpo.
Una nuova ricerca pubblicata su Nature Communications rivela dettagli strutturali innovativi su come si formano le malattie come il morbo di Alzheimer (MA). Con questa conoscenza, il gruppo potrebbe aver scoperto un meccanismo unico per invertire sia i depositi che il loro impatto su coloro che soffrono di queste condizioni.
Ronit Freeman, ricercatrice della UNC-Chapel Hill che guida un gruppo di ricerca con investigatori della Emory University, ha esaminato il peptide amiloide-beta42 (Aβ42), la porzione chiave che guida l'assemblaggio della placca amiloide e i depositi nel cervello dei pazienti con MA.
Creando varianti sintetiche del peptide in laboratorio, hanno scoperto come controllare il modo in cui queste molecole si raggruppano e si attorcigliano. La Freeman ha affermato:
"La capacità di questi materiali amiloidi di essere sciolti e degradati evidenzia il potenziale dei trattamenti che modificano e successivamente invertono le placche del MA e di altre malattie neurodegenerative.
“Sappiamo che la direzione degli intrecci della fibrilla amiloide è associata a diversi stati di progressione della malattia. Immagina che, con un semplice trattamento, potessimo modificare la forma degli amiloidi e farli scomparire: questo è ciò che la nostra scoperta potrebbe permetterci di fare in futuro".
Con tecniche spettroscopiche avanzate, i ricercatori hanno sondato come interagiscono i singoli peptidi, rivelando informazioni su tassi di assemblaggio, distanze tra peptidi, allineamento dei peptidi e soprattutto la direzione della torsione. È stata utile la microscopia elettronica e fluorescente ad alta risoluzione per caratterizzare la morfologia dei materiali a diverse temperature.
Gli investigatori hanno chiarito che il dominio terminale-N del peptide è importante per programmare la forma dell'assemblaggio come tubi, nastri o fibre, mentre le modifiche al terminale-C dirigono una torsione sinistra o destra all'interno del materiale.
Usando queste regole, hanno messo a punto una serie di peptidi per cambiare su richiesta tra nastri intrecciati a destra e a sinistra in risposta a temperature mutevoli. Questa inversione di torsione rende quindi il materiale suscettibile al degrado da parte delle proteine naturali, una caratteristica desiderabile per i materiali usati come veicoli di consegna.
Fonte: University of North Carolina at Chapel Hill via EurekAlert! (> English) - Traduzione di Franco Pellizzari.
Riferimenti: SJ Klawa, [+11], R Freeman. Uncovering supramolecular chirality codes for the design of tunable biomaterials. Nat Commun, 2024, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.













 Associazione Alzheimer OdV
Associazione Alzheimer OdV