Una scoperta rivela che una proteina, che di norma è coinvolta nell'eliminazione di detriti molecolari delle cellule, può raggrupparsi in fibrille, mutilando potenzialmente le cellule.
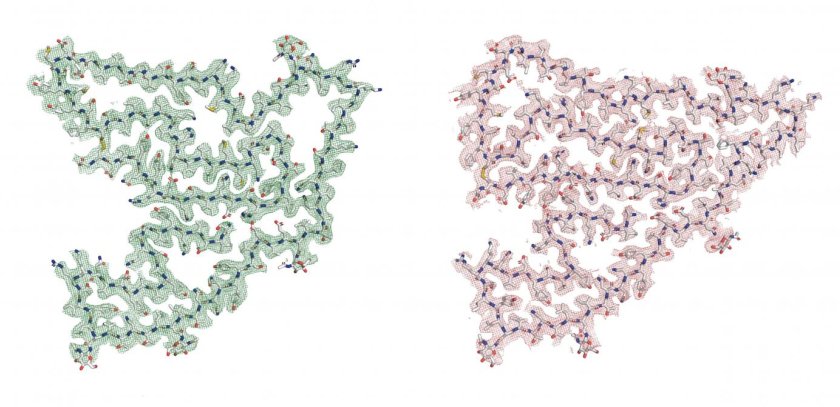 Un frammento cruciale della proteina TMEM106B, della quale sono evidenti diversi modelli atomici, può impilarsi in tipi singoli o gemelli di fibrille. (Fonte: A Chang e A Fitzpatrick)
Un frammento cruciale della proteina TMEM106B, della quale sono evidenti diversi modelli atomici, può impilarsi in tipi singoli o gemelli di fibrille. (Fonte: A Chang e A Fitzpatrick)
Fai un giro in profondità nelle cellule di un cervello afflitto dal morbo di Alzheimer, e troverai minuscoli ciuffi di proteine che sembrano sospetti. Sin dagli anni '80, quando i neuroscienziati hanno iniziato a identificare questi grovigli di proteine, i ricercatori si sono accorti che altre malattie cerebrali hanno le proprie firme di proteine aggrovigliate.
"Ognuna di queste malattie ha un groviglio proteico unico, o fibrilla, associato a essa; queste proteine associate alle malattie hanno la propria forma e comportamento", ha detto Anthony Fitzpatrick PhD, ricercatore dell'Istituto Zuckerman alla Columbia University, assistente professore di biochimica e biofisica molecolare della Columbia e membro del Taub Institute for Research on Alzheimer’s Disease and the Aging Brain.
La ricerca del dott. Fitzpatrick e di un team internazionale di 22 collaboratori, pubblicata su Cell, ha rivelato una nuova fibrilla nei cervelli malati, formata da una proteina che di norma è occupata nella pulizia delle cellule.
"Abbiamo un risultato sorprendente e provocatorio che speriamo possa darci qualche aiuto per gestire le malattie neurodegenerative", ha affermato il laureando Andrew Chang, un primo coautore dello studio, del laboratorio di Fitzpatrick.
I ricercatori di farmaci stanno cercando da tempo le proteine che formano grovigli, come obiettivi per nuovi medicinali, ma le loro ricerche finora hanno avuto in gran parte risultati deludenti. Le malattie associate alle fibrille, alcune comuni e altre rare, influenzano collettivamente milioni di persone in tutto il mondo.
Si prevede che la loro incidenza aumenti con la crescita della popolazione e l'allungamento della vita. Sgrovigliare cosa sta succedendo in queste malattie neurodegenerative ha un aspetto personale per il dott. Fitzpatrick: ha perso uno zio in una di esse, la paralisi sopranucleare progressiva (PSP).
"Abbiamo scoperto che una proteina chiamata TMEM106B può formare fibrille, e questo comportamento non era noto finora", ha detto Xinyu Xiang, ex del laboratorio di Fitzpatrick all'Istituto Zuckerman e ora dottoranda nel Dipartimento di Biologia strutturale della Stanford University. "Questa proteina è una componente centrale dei lisosomi e degli endosomi, che sono organelli che eliminano la spazzatura che si accumula nelle nostre cellule mentre invecchiamo".
Normalmente, le molecole TMEM106B coprono le membrane degli organelli che gestiscono i rifiuti. Nella ricerca, la squadra di Fitzpatrick ha scoperto che le molecole TMEM106B possono dividersi in due frammenti, e quelli all'interno degli organelli possono quindi auto-assemblarsi in ciò che i ricercatori sospettano potrebbero essere fibrille che mutilano le cellule.
Per arrivare a questa scoperta, i ricercatori hanno estratto per la prima volta le proteine dal tessuto cerebrale donato da 11 pazienti che erano morti con tre malattie neurodegenerative associate a proteine mal ripiegate: PSP, demenza da corpi di Lewy e degenerazione lobare frontotemporale (la forma più prevalente di demenza per chi ha meno di 60 anni).
"È così motivante ricordare che l'unico modo in cui possiamo fare questa ricerca è per merito di persone che hanno generosamente donato il loro cervello", ha affermato Marija Simjanoska, una prima coautrice e uno dei tre universitari che lavorano al progetto.
Fonte: Columbia University (> English) - Traduzione di Franco Pellizzari.
Riferimenti: A Chang, ...[+21], AWP Fitzpatrick. Homotypic fibrillization of TMEM106B across diverse neurodegenerative diseases. Cell, 2022, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
















 Associazione Alzheimer OdV
Associazione Alzheimer OdV